鳥インフルエンザA(H7N9)ウイルスによる感染事例に関するリスクアセスメントと対応
2022年4月22日現在
2023年12月8日一部更新
国立感染症研究所
PDF
更新点
2023年12月8日 「日本人渡航者が感染するリスク」内に受診時に鳥類との接触歴を伝える必要性について追記
目次
- 背景
- 疫学的所見
1)事例の概要
2)臨床情報
3)感染源・感染経路 - ウイルス学的所見
- 日本国内の対応
- リスクアセスメントと今後の対応
背景
A型インフルエンザウイルス(H7N9亜型)(以下、H7N9ウイルス)は、家きんや野鳥で流行していた少なくとも3種類の異なるA型インフルエンザウイルスの遺伝子再集合体であると考えられ (Liu WJ, 2021)、ヒトに感染すると重篤な症状を来し得ることが報告されている(CDC, 2017)。中国における2018-2019年シーズン以降のH7N9ウイルスの感染者数は1例のみであった。2018-2019年シーズン以降の状況について疫学情報及びリスクアセスメントを更新する。
疫学的所見
1)事例の概要
- H7N9ウイルスに感染した最初の患者は、2013年3月に中国から世界保健機関(WHO)へ報告された。以後、2022年3月18日時点で、中国本土からの報告例、もしくは中国本土に滞在歴があるか、中国本土から輸入した家きんとの接触歴のある台湾・香港・マカオ・マレーシア・カナダからの報告例を含め、計1,568例が報告されており、うち少なくとも616例(39%)が死亡している(FAO, 2022)。患者の発生は、中国での冬季にピークを示し、2013年から現在までで5つのピークを認めている(WHO, 2019)(図1参照)。
- 中国における第5波までの患者報告数は欧州疾病予防管理センター(ECDC)のみが公開しており(2018年4月6日現在)、第1波は135例、第2波は320例、第3波は223例、第4波は120例、第5波は766例であった(ECDC,2018)。以降のシーズンについては患者数が減少し、2017-2018年シーズンは3例、2018-2019年シーズンは1例のみであった。2022年3月18日現在、最終報告例は2019年3月に発症した1例であり、この患者は甘粛省在住で内モンゴル自治区にて感染したと推定された(WHO, 2019)。2015年10月から始まった第4波までに患者や家きんなどから分離されたH7N9ウイルスは家きんに対して病原性が低い低病原性鳥インフルエンザウイルス(以降、高病原性鳥インフルエンザウイルスと区別する場合は、LPAI-H7N9ウイルスとする)であったが、2016年10月以降の第5波では患者および生鳥市場や農場の鶏や環境検体から鶏に対して高い病原性を示す高病原性鳥インフルエンザウイルス(HPAI-H7N9ウイルス)が分離されている(Qi W, 2018 ; Tanikawa T, 2019)。
- 中国の研究グループによる第1~5波の計40クラスター(少なくとも2例以上のリンクのある患者)の特徴の解析によると、第5波と第1~4波のクラスターの数及び規模やヒト-ヒト感染の割合は似た傾向を示した。このうち14のクラスターでヒト-ヒト感染が疑われ、そのうち4つのクラスターでは家庭内、10のクラスターでは病院内(うち3例が血縁関係あり)におけるリンクが確認されている。これまでに、3次感染例は認めていない(Zhou L, et al. 2018)。
2)臨床情報
-
これまでの報告から、ヒトにおける潜伏期間は3日~7日(最長10日)と推定されている(Li Q, et al,2014)。
- 発熱、咳嗽、呼吸困難、頭痛、筋肉痛、全身倦怠感などの症状が出現し、患者の多くは、重症肺炎の病像を呈する(Ke Y, 2013)。一方で、軽症から中等度の病像を呈し、インフルエンザ様疾患に対する病院定点サーベイランスで探知された報告もある(Ip DK, et al, 2013)。
- 死亡10例と生存30例を比較した疫学研究によると、死亡のリスク因子として高齢、慢性肺疾患、免疫不全状態、長期の投薬歴、オセルタミビル投与の遅延(発症から治療までの中央値は生存例で4.6日、死亡例で7.4日。両群ともオセルタミビル感受性あり)が報告されている(Liu S, 2013)。
- HPAI-H7N9ウイルスは、鶏などの一部の家きんに対しては致死的であるが、ヒトへの病原性の上昇は認められておらず、LPAI-H7N9ウイルスと比べて、患者の年齢、発症から入院までの日数などに有意な差はないことが報告されている (Yang Y, 2019)。
- 鳥インフルエンザA(H7N9)に関して、リアルタイムRT-PCR法による呼吸器検体を用いた検査が推奨されている(CDC, 2022, WHO,2021)。
3)感染源・感染経路
- 第5波(2016-2017)で、ヒト感染例の報告が急増した原因の一つとして、生鳥市場や生鳥に関連する環境からのサンプル中のH7N9ウイルス陽性率の増加が2016年の12月に認められ、以前の流行より相対的に早かったことが指摘された(Zhou L, Tan Y, 2017)。また、生鳥市場や農場中の環境検体や家きん検体からのウイルス検出が第4波までの同時期に比べて多数報告されていることや、第5波でも調査可能であった患者の90%で生きた家きんへの接触歴があり、そのうち80%以上で生鳥市場への訪問歴があったことが報告されている(Zhou L, Ren R, 2017)。
- 家きんへのワクチンを開始した2017年9月より、ヒトへの感染事例が減少しただけでなく、家きんにおけるH7N9ウイルスの浸潤率の低下が認められている(Shi J, 2018)。中国では、2017年7月に家きんに対するH7N9ワクチンの接種を行うため「全国HPAI予防接種計画」を策定した(農林水産省, 2018)。2021年9月時点で、28地域で94.21%の家きんが必要な免疫レベルを獲得している。
- しかしながら、H7N9ウイルスは家きんから根絶されたわけではない。2020年1月から2021年9月の中国における家きんまたは環境検体から2020年5月と10月にそれぞれ3検体と14検体でH7N9ウイルス陽性が報告されている(図2)(FAO, 2022)。また、2018年2月から2021年4月にかけて行われた調査では、HPAI-H7N9ウイルスが鶏やアヒルなどから分離されており、H7N9ウイルスの家きんでの流行は継続しているとみられる(He D, 2021, Yin X, 2021)。
- WHOによる直近の報告では、2021年6月には雲南省の鶏からH7N9ウイルスが検出された(WHO, 2022).
ウイルス学的所見
- H7N9ウイルス(HPAI-H7N9ウイルスも含む)は、継続的にヒト-ヒト間で感染伝播するような能力は獲得していない(Zhou L, Tan Y, 2017; Watanabe T, 2013; Xiong X, 2013; Tharakaraman K, 2013)。
- LPAI-H7N9ウイルスの主な遺伝子解析所見については、2014年のリスクアセスメントに記載している(国立感染症研究所, 2014)。
- 第5波にヒトおよび鶏から分離されたHPAI-H7N9ウイルスが、インフルエンザ感染のモデル動物であるフェレットにおいてLPAI-H7N9ウイルスと同様に効率は良くないが飛沫感染で感染伝播すること、さらに一部のウイルスでフェレットに対して致死感染伝播を示す場合があることが報告された(Imai M, 2017; Shi J, 2017)。さらに、哺乳動物に馴化した変異(PB2-627Kや701N)を獲得したHPAI-H7N9ウイルスでは、飛沫感染伝播の効率がさらに高まることが報告された(Shi J, 2017)。
- 2018年から2019年に家きんから分離された一部のH7N9ウイルスにおいて、発生初期のH7N9ウイルスと比べたヒト型レセプターへの結合能の低下や当時使用されていた家きん用ワクチン株との抗原性変異に起因する鶏でのワクチン防御能の低下が報告された(Yin X, 2021)。ただし、現在は、家きん用H7N9ウイルスワクチン株は更新されている。さらに、HPAI-H7N9ウイルスと鳥類で流行しているA型インフルエンザウイルスとの新たな遺伝子再集合体であるHPAI-H7N2ウイルス(Shi J, 2018; Qiu Y, 2019)やHPAI-H7N3ウイルス(Nakayama M, 2019)などが家きんから分離されており、継続的な家きんでの調査が必要である。なお、これらの遺伝子再集合体によるヒト感染事例は報告されていない。
- 米国疾病管理予防センター(CDC)の報告によると、GISAIDに登録された第5波のヒト感染例および生鳥市場環境から集められた74株のH7N9ウイルスのHA遺伝子の塩基配列解析から、遺伝子系統樹では大きく2つのクラスターに分かれ(Pearl River Delta群とYangtze River Delta群)、そのうち93%(69株)はYangtze River Delta群に属することを明らかにしている(WHO, February 2017)。WHOインフルエンザ協力センター(CDC, 米国St Jude小児研究病院)で実施された抗原解析の結果、Pearl River Delta群に属するウイルスはWHOが推奨する2013年のヒト用ワクチン候補ウイルスと抗原的に類似しているが、2016年以降に主流となっているYangtze River Delta群に属するウイルスはワクチン候補ウイルスから抗原性が変化しており、HPAI-H7N9ウイルスもこの群に含まれている。そのため、WHOは、2017年3月にこの群から新たに高病原性鳥インフルエンザウイルスを含む2株のヒト用ワクチン候補株(A/Guangdong/17SF003/2016-like virus, A/Hunan/2650/2016-like virus)を提案した(WHO, March 2017)。その後、2019年に抗原性や疫学情報に基づいて、新たなヒト用ワクチン候補株(A/Gansu/23277/2019-like virus)が追加・提案されている(WHO, 2019b)。
日本国内の対応
- 現在、鳥インフルエンザA(H7N9)は二類感染症の特定鳥インフルエンザの一つに政令で指定されている。鳥インフルエンザA(H7N9)に感染した疑いのある患者が発生した場合における標準的な対応は、「中東呼吸器症候群(MERS)及び鳥インフルエンザA(H7N9)の二類感染症への追加後の対応について」(2015年1月21日健感発0121第2号)に示されている。
リスクアセスメントと今後の対応
- CDCよりインフルエンザのパンデミック時に個々のウイルスの評価と優先順位の決定のためにInfluenza Risk Assessment Tool (IRAT)が提唱されている。これには、ヒト-ヒト感染持続の可能性(emergence)とヒト-ヒト感染が持続した際の公衆衛生へのインパクト(public health impact)という2つの評価分野があり、それぞれについてリスク評価が行われる。現在、H7N9ウイルスは評価対象となっている鳥インフルエンザのなかでは最も高い、中から高レベルのリスクに分類されている(CDC, 2021)。引き続き、家きんや野鳥、及びヒトにおける発生状況を注視していく必要がある。
【日本人渡航者が感染するリスク】
- 鳥やヒトの鳥インフルエンザH7N9ウイルス感染の発生が確認されている地域へ渡航する際には、生鳥市場への訪問や病鳥との接触を控えるなどの注意喚起は継続すべきである。
- 発生地域において鳥類との接触があり、渡航後に発熱を認めるなどの体調の変化があった場合には、医療機関の受診時に渡航歴及び鳥類との接触歴を伝えることの啓発が必要である。
【鳥インフルエンザH7N9ウイルスが持続的なヒト-ヒト感染を起こすリスク】
- 限定的なヒト-ヒト感染は確認されているが、先に記した疫学的・ウイルス学的所見から、ヒトへの感染が確認されているH7N9ウイルスは、ヒト-ヒト間で容易に感染伝播するような能力は獲得しておらず、持続的なヒト-ヒト感染の可能性は低いと考えられる。
- 第5波(2016-2017)ではHPAI-H7N9ウイルスが生鳥市場の環境や家きんから分離され、このウイルスに罹患した患者も報告された。これまでのところ、HPAI-H7N9ウイルスの出現でヒトに対する疫学的パターンに変化がみられた証拠はなく、低病原性ウイルスから高病原性ウイルスへの変異により、ヒトでの病原性や感染力に影響を及ぼすという科学的な根拠は認められていない(WHO, February 2017)。今後も、H7N9ウイルスに関する情報を収集し、適宜リスクアセスメントを実施する必要がある。
参考文献
•農林水産省. 中国の鳥インフルエンザに関する情報. 2018年3月30日.
•国立感染症研究所. 鳥インフルエンザA(H7N9)ウイルスによる感染事例に関するリスクアセスメントと対応. 2014年1月29日. https://www.niid.go.jp/niid/ja/diseases/a/flua-h7n9/2276-a-h7n9-niid/4324-riskassess-140129.html.
•CDC, Update: Increase in Human Infections with Novel Asian Lineage Avian Influenza A(H7N9) Viruses During the Fifth Epidemic — China, October 1, 2016–August 7, 2017 Weekly / September 8, 2017 / 66(35);928–932
•CDC. Summary of Influenza Risk Assessment Tool (IRAT) Results. last reviwed on December 2, 2021. https://www.cdc.gov/flu/pandemic-resources/monitoring/irat-virus-summaries.htm.
•CDC. Interim Guidance for Specimen Collection, Processing, and Testing for Patients with Suspected Infection with Novel Influenza A Viruses Associated with Severe Disease in Humans. last reviewed on January 14, 2022. https://www.cdc.gov/flu/avianflu/h7n9/specimen-collection.htm.
•ECDC. Communicable Disease Threats Report, 7 April 2018.
•FAO. H7N9 situation update. 02 March 2022. http://www.fao.org/ag/againfo/programmes/en/empres/h7n9/Situation_update.html
•He D, Gu M, Wang X, et al, Spatiotemporal Associations and Molecular Evolution of Highly Pathogenic Avian Influenza A H7N9 Virus in China from 2017 to 2021. Viruses. 2021; 13(12):2524. https://doi.org/10.3390/v13122524; Yin X, Deng G, Zeng X, et al. Genetic and biological properties of H7N9 avian influenza viruses detected after application of the H7N9 poultry vaccine in China. PLoS Pathog. 2021,17(4):e1009561.
•Imai M, Watanabe T, Kiso M, et al. A highly pathogenic avian H7N9 influenza virus isolated from a human is lethal in some ferrets infected via respiratory droplets. Cell Host & Microbe. 2017; 22:1–12.
•Ip DK, Liao Q, Wu P, et al. Detection of mild to moderate influenza A/H7N9 infection by China’s national sentinel surveillance system for influenza-like illness: case series. BMJ. 2013;346:f3693.
•Ke Y, Wang Y, Liu S, et al. High severity and fatality of human infections with avian influenza A(H7N9) infection in China. Clin Infect Dis. 2013;57:1506.
•Li Q, Zhou L, Zhou M, et al. Epidemiology of human infections with avian influenza A (H7N9) virus in China. N Engl J Med. 2014;370:520.
•Liu S, Sun J, Cai J, et al. Epidemiological, clinical and viral characteristics of fatal cases of human avian influenza A(H7N9) virus in Zhejiang Province, China. J Infect. 2013;67(6):595-605.
•Liu WJ, Xiao H, Dai L, et al. Avian influenza A (H7N9) virus: from low pathogenic to highly pathogenic. Front Med. 2021;15(4):507-527.
•Nakayama M, Uchida Y, Shibata A, et al, A novel H7N3 reassortant originating from the zoonotic H7N9 highly pathogenic avian influenza viruses that has adapted to ducks. Transbound Emerg Dis. 2019; 66(6):2342-2352.
•Qi W, Jia W, Liu D, et al. Emergence and Adaptation of a Novel Highly Pathogenic H7N9 Influenza Virus in Birds and Humans from a 2013 Human-Infecting Low-Pathogenic Ancestor. J Virol. 2018;92(2):e00921-17.
•Qiu Y, Sun R, Hou G, et al. Novel reassortant H7N2 originating from the H7N9 highly pathogenic avian influenza viruses in China, 2019. J Infect. 2019, 79(5):462-470.
•Shi J, Deng G, Kong H, et al. H7N9 virulent mutants detected in chickens in China pose an increased threat to humans. Cell Res. 2017 :1-13.
•Shi J, Deng G, Ma S, et al. Rapid Evolution of H7N9 Highly Pathogenic Viruses that Emerged in China in 2017. Cell Host & Microbe 2018, 24(4),558-568.e7
•Tanikawa T, Uchida Y, Takemae N, et al. Pathogenicity of two novel human-origin H7N9 highly pathogenic avian influenza viruses in chickens and ducks. Arch Virol. 2019;164(2):535-545.
•Tharakaraman K, Jayaraman A, Raman R, et al. Glycan receptor binding of the influenza A virus H7N9 hemagglutinin. Cell. 2013;153(7):1486-93.
•Watanabe T, Kiso M, Fukuyama S, et al. Characterization of H7N9 influenza A viruses isolated from humans. Nature. 2013;501(7468):551-5.
•World Health Organization. Analysis of recent scientific information on avian influenza A(H7N9) virus. 10 February 2017.
•World Health Organization. Antigenic and genetic characteristics of zoonotic influenza viruses and development of candidate vaccine viruses for pandemic preparedness. March 2017.
•World Health Organization. Influenza at the human-animal interface Summary and assessment, 13 February to 9 April 2019a, https://www.who.int/publications/m/item/influenza-at-the-human-animal-interface-summary-and-assessment-9-april-2019
•World Health Organization. Weekly epidemiological record. 18 OCTOBER 2019, 94th YEAR No 42, 2019b, 94, 473–496
•World Health Organization. WHO information for the molecular detection of influenza viruses. February 2021. https://cdn.who.int/media/docs/default-source/influenza/molecular-detention-of-influenza-viruses/protocols_influenza_virus_detection_feb_2021.pdf?sfvrsn=df7d268a_5
•World Health Organization Influenza at the human- animal interface Summary and assessment, from 22 January to 1 March 2022 https://www.who.int/publications/m/item/influenza-at-the-human-animal-interface-summary-and-assessment-1-march-2022.
•Xiong X, Martin S, Haire LF, et al. Receptor binding by an H7N9 influenza virus from humans. Nature. 2013;499(7459):496-9.
•Yang Y, Wong G, Yang L, et al. Comparison between human infections caused by highly and low pathogenic H7N9 avian influenza viruses in Wave Five: Clinical and virological findings. J Infect. 2019;78(3):241-248
•Yin X, Deng G, Zeng X, et al. Genetic and biological properties of H7N9 avian influenza viruses detected after application of the H7N9 poultry vaccine in China. PLoS Pathog. 2021,17(4):e1009561.
•Zhou L, Ren R, Yang L, et al. Sudden increase in human infection with avian influenza A(H7N9) virus in China, September–December 2016. Western Pac Surveill Response J. 2017;18;8(1):6-14.
•Zhou L, Tan Y, Kang M, et al. Preliminary Epidemiology of Human Infections with Highly Pathogenic Avian Influenza A(H7N9) Virus, China, 2017. Emerg Infect Dis. 2017;23(8):1355-1359.
•Zhou L, Chen E, Bao C, et al. Clusters of Human Infection and Human-to-Human Transmission of Avian Influenza A(H7N9) Virus, 2013–2017 , Emerg Infect Dis. 2018;24(2).
国立感染症研究所が提供する関連資料
•鳥インフルエンザA(H7N9)ウイルス感染症に関する臨床情報のまとめ:臨床像・検査診断・治療・予防投薬 (2013年4月26日)
http://www.nih.go.jp/niid/ja/diseases/a/flua-h7n9/2273-idsc/3492-clin-info.html
•鳥インフルエンザA(H7N9)ウイルス感染症に対する院内感染対策(2013年5月17日)http://www.nih.go.jp/niid/ja/diseases/a/flua-h7n9/2273-idsc/3550-hospital-infection.html
•鳥インフルエンザA(H7N9) 患者搬送における感染対策(2014年7月16日)http://www.nih.go.jp/niid/ja/diseases/a/flua-h7n9/2273-idsc/4859-patient-transport-mersandh7n9.html
作成
感染症危機管理研究センター 竹前喜洋、影山努、太田雅之、齋藤智也
実地疫学研究センター 島田智恵
FETP 23期 大森俊、田畑早季子
インフルエンザ・呼吸器系ウイルスセンター 渡邉真治、長谷川秀樹
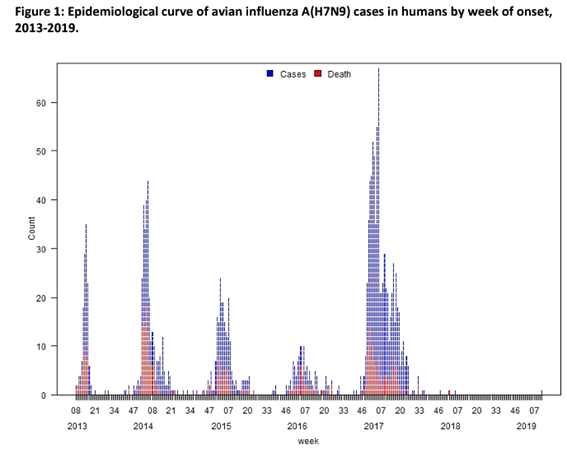
図1.鳥インフルエンザA(H7N9)ウイルスのヒトへの感染例 n=1568(2019年4月9日現在, 文献1から引用)
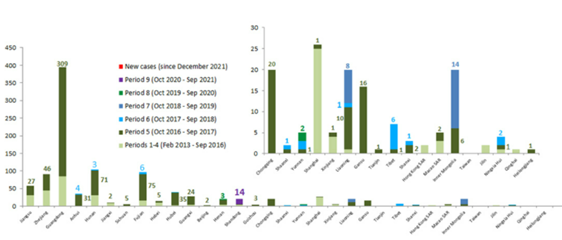
図2.中国本土の鳥と環境における鳥インフルエンザA(H7N9)の検出地域別陽性検体数 2013年2月~2022年2月2日
(Food and Agriculture Organization of the United Nations, H7N9 situation update, 02 March 2022 https://www.fao.org/ag/againfo/programmes/en/empres/H7N9/Situation_update.html)