お知らせ
感染症情報
研究・検査・病原体管理
サーベイランス
刊行・マニュアル・基準
お知らせ
感染研市民セミナー 「最近のヒト・動物インフルエンザの流行状況」

感染研市民セミナー(第49回) 「くらしに役立つ病気の知識」 最近のヒト・動物インフルエンザの流行状況 国立感染症研究所(村山庁舎)では、毎日を健康に明るく過ごすための情報を、分かりやすく提供する市民公開セミナー「くらしに役立つ病気の知識」をシリーズ...
続きを読むIASR最新号 特集記事
IASR 45(4), 風疹・先天性風疹症候群 2024年2月現在
風疹・先天性風疹症候群 2024年2月現在 (IASR Vol. 45 p51-52: 2024年4月号) 風疹は風疹ウイルスによる急性感染症であり, 発熱, 発疹, リンパ節腫脹を主徴とする。風疹に対する免疫が不十分な妊婦が風疹ウイル...
続きを読む研究トピックス
- オートファジーマトリクス解析から見えてきた宿主の6つのAtg8 パラログと細胞内で肺炎球菌が産生するH2O2の新たな機能 (細菌学) 2024年04月26日
- 標準化した薬剤感受性検査を加えたナショナル・ゲノムサーベイランスにより明らかになった腸内細菌目細菌の薬剤耐性 (疫学) 2024年04月19日
- クライオ電子顕微鏡解析とX線結晶構造解析による遺伝子型GI.4ノロウイルスのヒト型モノクローナル抗体結合部位の解明 (ウイルス学) 2024年04月15日
- 抗精神病薬ロキサピンは2Cタンパク質を標的とし、A型肝炎ウイルスの複製を阻害する (ウイルス学) 2024年03月26日
- 肺炎球菌はエンドソーム膜上のシアル酸を刈り取ることで自身が産生する膜孔形成毒素の過剰な働きを抑制し、宿主細胞による排除から身を守る (細菌学) 2024年03月15日
生命、細胞、生体膜
Living organization is maintained by extracting ‘order’ from the environment --- 1944, Erwin Schrödinger (1887-1961)
生き物は環境から「秩序」を引き抜いていることで維持されている --- 1944年 アーウィン・シュレディンガー(1887年-1961年)
生命の本質は何であろうか?
「生命とは何か?」、「生きているということはどういうことか?」という問いは多くの人にとっては自明なことであり、「くどくど考えなくても見てればわかるだろう。」と思われるかもしれません。しかし、答えを考え出すとなかなか言葉では言い尽くせない問いであり、少々固い言葉でいうところの「生命を定義する」ことは実に困難なのです。時代の変遷により考え方が少しずつ変わるというように流動的でさえあります。
最近の社会的問題としては「脳死は死か?言い換えれば、脳死状態の人は人間として生きていると判断できるのか否か?」という難しい問題が提起されたことは皆さんご存知でしょう。
私のこの小文の目的は、生命の最小単位である細胞は生きるためにそれを包んでいる生体膜と呼ばれる構造を持つことが必須であり、生体膜には構成成分として脂質と呼ばれる生体物質が存在していることがとても重要であるということを説明することにあります。その目的に行きつくまでに、回りくどいようですが「生命とは何か?」ということを考えるところから始めます。
生き物とはどういうものかを考えると、「子孫が作れるもの」、「炭素、水素、窒素を主な材料として形成されているもの」、「核酸を持ち、他の生命体に寄生せずに自己複製能を有するもの」などいろいろな解答案が挙げられましょうが、我々が知っている生物にかなり共通している性質を示してはおりますものの、これらの属性によって生命を過不足なく定義できるとは思えません。ラバは、雄のロバと雌のウマの交雑種であり、不妊のためラバ同士で子孫は作れませんが、誰が見てもラバは生き物です。
とすると、生命の本質もしくは生き物らしさというものは子孫維持能力とは別なところにありそうです。このことは、20世紀初頭には物理学者たちから指摘され、生命体を動的秩序(dynamic order)とか非平衡の熱力学(non-equilibrium thermodynamics)もしくは散逸構造(dissipative structure)といった概念から考える機運が生まれてきました。これらの概念の詳細な説明は私の能力を超えておりますので、ほんのさわりの説明を以下に試みます。
私たちは、生き物のどのような性質を見たときに「これは生きている!」と感じるのかを考えてみてください。上に述べましたように「子孫維持能力」は生物が自然界に生き残るために必要な能力ではありますが、生き物であるための必須要件ではありません。
私たちは、自然環境に応じて変化したり動いたりする(硬度として)ソフトな質感を与える物体を見ると、一見してそれは生物ではないかと認識する傾向を持っていると思います。このような認識傾向があること自身、生物として持たねばならないなにかしらの基準があることを示しています。私たちは知らず知らずのうちにその判断基準を身に着けているのです。私が考えるに、その基準の第一条は、「動的秩序を自発的に持つシステム」ということになると思われます。
自発的に動的秩序を持つシステム
「動的秩序を自発的に持つシステム(Autonomous system with dynamic order)」と言われても多くの人には意味不明のことと思います。そこで先ず言葉の定義をしておきましょう。
動的(dynamic): 状態や構成が状況に応じて変化する性質。対立概念は静的(static)。
秩序(order): 物事がお互いのルールに従い配置または挙動していること。対立概念は無秩序または乱雑(disorder)。
自発的(autonomous): 自分自身の判断で行為する性質。自律的と言い換えてもよい。
システム(system): 相互に関連する、または相互に作用する要素の集まり。
システムという言葉は、さまざまなことで多用されますので、さらに説明を加えておきます。自然界全体の一部分であり、その構成要素がお互いに関連、作用しあっているのがシステムです。箱にいくら高価なITチップを放り込んでもシステムにはなりません。適切な配線を通じてそれぞれの要素が作用して全体としての機能を発揮することになって初めてこの箱状の物体はコンピュータと呼ばれるに相応しいシステムになります。
社会においては各人間、人間においては各臓器、臓器においては各細胞、細胞においてはDNAやタンパク質といった生体分子が、それぞれのシステムの主要素です。要素が単に集まっているだけでなく、それらが相互に関連して作用することが、社会、人間、臓器、細胞といったシステムを作ることに必須であることがお分かり頂けるでしょう。
本稿では以降、システムとは上記のようなものとして思い描いてください。そうすると、「動的秩序を自発的に持つシステム」とは、「構成要素がお互いのルールに従い配置または挙動しつつ、状況に応じて状態や構成要素が自身の判断による行為で変化するシステム」ということになります。
システムという概念は「系」と邦訳されます。Solar systemなら太陽系、Biological systemであれば生物系ということになります。ただし、「系」という日本語は生物系学科とか草食系男子というようにシステムという意味ではなく系統(lineage)という意味で出てくることもあるので区別が必要です。
秩序と無秩序
秩序と無秩序および動的と静的についても少し話を加えます。秩序とは、物事がお互いのルールに従い配置または挙動していることと先述しました。この定義は社会の秩序や細胞の秩序というような目視または光学顕微鏡で見えるようなサイズのものについてはしっくりと当てはまりましょうが、分子のようにさらに微細なものになると対立概念である無秩序から把握したほうがわかりやすいかもしれません。以下、本稿では乱雑という言葉を無秩序と同義として使用します。
システムを構成する要素が規則性なく分布し動いている状態が乱雑な状態です(下に描いた部屋の状況を見てください)。微視的に見たときに分子の取りうる状態の数が大きいほどより乱雑であるとみなされます。「分子の取りうる状態の数」という事柄は、水と油が分離することにも密接に関わることであり、機会があれば別途触れたいのですが、なかなか簡潔に説明できそうもありません。そこで、ここでは部屋の中が乱雑でよいなら物のおけるパターンは多くあるという日常の経験と結びつけてイメージしてください(部屋の状況図参照)。熱力学用語としてはエントロピーと呼ばれる言葉が乱雑さを表す指標となっており、乱雑さがひどくなることをシステムのエントロピーが大きくなるというように表現します。

分子の集団は乱雑さがひどくなる方向(エントロピーが大きくなる方向)へとは自然と進みますが、その逆方向(つまり秩序ある方向)に向かわせるのは相応するエネルギーを使う必要があります。
生き物は動的秩序を自発的に作り出します。すなわち、構成要素がお互いのルールに従い配置または挙動しつつ、状況に応じて状態や構成要素が生き物自身の中にプログラム化されている判断基準に沿って変化しているということです。生物は、主に物質代謝から得た化学エネルギーを利用して低分子から高分子を作り、状況に対応した新たな体制を整えることを常に行っています。そして、死ねばこのような行為を自発的に行うことはなくなります。
全ての生物が持つ「動的秩序の自発性」の観点から脳死の判断を解釈すると、さまざまな臓器の動的秩序は最新の医療機器の助けを借りて維持できようとも、維持するための自発性が不可逆的に喪失している場合は生物としての死と考えうるのかもしれません。
動的秩序を自発的に形成維持する生物
動的秩序システムとは、構成要素がお互いのルールに従い配置または挙動しつつ、状況に応じて状態や構成要素が変化するシステムと説明しました。生物における構成要素は、主に炭素、窒素、酸素、水素、リンから成り立っており、金属などに比べれば柔らかい物性を示します。このあたりの基準を満たすシステムであるといかにも生物らしい感じがしてきます。その上で自己複製能(細胞分裂や産卵・出産)さえも見られればほぼ生物と認定されそうですね。
実は、動的な秩序を持つシステムは生物に限ったことではありません。あとで少しふれますように地球も動的な秩序を持つシステムです。工学的なシステム、例えば自動車やコンピュータなども動的な秩序を持つシステムといえましょう。ただし、人工的な産物の多くは、その構成要素が状況によって自発的に変化するということは通常ありません。修理や新機種開発というように人間の力を借りて構成要素を変えることはありますが。
生物は構成要素を生物自身の活動によって変化させています。身近な例では、生まれたばかりの赤ちゃんと、その子が成人になったときとでは、同じ個人でありながら各臓器の大きさは育つ間にものすごく変化しますよね。それだけではありません。微視的にみれば、生まれたその瞬間に体を形成している個々の原子で老年期までそのまま残っている原子はほとんど存在しないのです。新陳代謝で置き換わっているからです(このことは、モデル生物を同位体原子で代謝標識することにより実験的に検証可能です)。細胞を構成する分子のレベルにおいて、私たちの身体は、無意識のうちに自発的に部品交換修理を常時行いながら維持されているわけです。一方、廃車時の自動車エンジンを構成している一つ一つの原子は、途中でエンジン交換しない限り、新車の際の原子そのものです。
よって、現在知られている動的秩序システムを見渡した時、たとえマッハ越えのスピードで動けたり、一秒に一兆回の計算ができたりしたとしても、人工システムのダイナミズムは自発的変化能を兼ね備えた生物のダイナミズムには及んでいないと私は考えております。
システムの境界
システムには内外の境界borderが存在します。境界は、物質的なものである場合もありますし、概念的な場合であることもあります。自動車ならばその境界は車体ボディー表面となるでしょう。一方、党派閥のような人間集団システムでは、構成員と非構成員との間の概念的もしくは精神的な区別があればよいのであって、物理的な境界で区別する必要はありません。
物事はなにかしらの境界があって他(外部)と区別しているわけですから、宇宙全体を指すことでもないかぎりシステムには境界はつきものなのです。システムの境界は、何でも出入り自由というような漠としたものではいけません。物理的にせよ、精神的にせよ、システム要素の出入りに制限がかけられるようなバリア機能を持つ必要があります。先に断っておきますが、バリアを外部と相互作用しないための仕組みと誤解しないでください。外部と全く相互作用しないで維持可能な動的システムというのは自然界にはありません。
また、境界があやふやな場合もしばしばあります。地球と地球外の境を地上何メートルと定めることは不可能でしょう(追記も参照)。それでも遠く宇宙からの映像を見ればやはり地球は地球外と分けて考えることのできる一つのシステムです。
以下では、精神的バリアで選別される社会的システムは対象にせず、物質的バリアを持つことで成り立つ動的秩序システムに限って話を進めます。
(追記) 航空分野では、海抜高度100 kmに(カーマン・ライン, Karman lineと呼ばれる)仮想的なラインを引き、地球の大気圏と宇宙との境と定めているそうです。それとても100 kmを80 kmに見直そうという議論があるということなのでやはり地球と地球外との境は「あやふや」なのでしょう。(2019年11月8日)
動的な秩序の維持に必要なエネルギーの流れ
動的な秩序を持つシステムを形成するには、システムの内と外とのエネルギーや物質の出入りが必要です。光なども素粒子レベルの物質とみなせば、エネルギーの流れは物質の流れとして統一して考えてもよいのかもしれません。
先述しましたように、物事は放置すれば無秩序になる方向に自然と動いてしまいます。そこで、システムは外部から流入したエネルギーを使用して内部の秩序を戻す活動を継続しています。そして、その際に必然的にできてしまう質の悪いエネルギー(システム内でもはや使いようのないタイプのエネルギー。例えば、構成要素がいっそう乱雑に運動することでできる熱エネルギー)は廃棄します。このようなエネルギーの流れの中でシステム内の動的秩序は維持できているのです。このことは、熱力学の法則に則った事象ですので、生物に限らず「秩序を維持している」システム全般に当てはまります。
例えば、地球は、太陽からエネルギーを受ける一方で多くのエネルギーを放射熱として宇宙空間に発散しつつあり、このエネルギーの流れの中で水の惑星らしいさまざまな自然の営みを維持しています。生物においては、エネルギー源は主に食物ですので物質としての供給と廃棄は欠かせませんし、生命活動でできてしまう熱の廃棄も必須です。
内と外とのエネルギーや物質の出入りを適切に行っているシステムの境界には必ず備えるべき性質があります。必要なものは取り込み、捨てるべきものは出せるという性質です。無選別に物質を出し入れするようではシステム内部の要素がそもそも維持できず、動的秩序は成り立ちません。
ここまでで私の研究の主たる対象である生体膜や脂質の話への準備としての「生命システムの性質」の話題を終えて、生命の基本単位である細胞に目を移してみましょう。
細胞と生体膜
All living things are composed of cells -– 1839, Theodor Schwann (1810-1882)
生きているものは全て細胞から成り立っている -– 1839年 テオドール・シュワン(1810年-1882年)
細胞説
生物の基本単位である細胞を構成している膜構造の総称が生体膜です。生体膜は6~10 nm (nmは mmの百万分の一)程度の厚さをもつ袋状の構造体であり、主にタンパク質と脂質から作られています。
生体膜が注目されてきた背景を語る前に、先ず「細胞」という概念が確立されてきた歴史を簡単に紹介します。
17世紀 顕微鏡の発達によって生物の構成成分の理解 が進み、「細胞」の概念が生まれてきました。この黎明期に特に重要な働きをしたのが、英国の自然哲学者ロバート・フック(Robert Hooke、1635年-1703年)です。
ちなみにこの時代、科学scienceという言葉はまだありません。当時の西欧人は、キリスト教における神の摂理こそ真の知識という信心をあまねく持っており、この宗教的原則を逸脱した考えを公にすることはタブーでした。よって、キリスト教発祥以前の古代ギリシャで生まれたとされるphilosophy(智を愛する精神活動たる哲学)も、17世紀の西欧では、神の摂理たる真の知識を知ることを目指す学問分野だったわけです。そして、神の創造物たる自然にも真の知識は反映されているはずであるからそれを知ろうとする哲学分野を特に自然哲学natural philosophyとしていたようで、かのニュートン(1642年-1727年)も自然哲学者と自称していたそうです。
自然現象の細かい機序が今のように明らかになってきたことの原動力ともいえる思想は、「複雑なことは要素に分解してより単純な問題として解析する(還元的分析法と呼ばれるものです)」とする思想です。この還元的分析という考え方もやはり17世紀に活躍したデカルト(Descartes, 1596年-1650年)により提唱されております。
私が思うに、論考の仕方の面で17世紀以降の自然哲学と現在の自然科学との間に大きなギャップはあまりありません。自然界に起こっている物事を神の問題と切り離して探究するという立場を鮮明にしているのが現代自然科学であると思われます。
話をフックに戻しますと、彼は自作の顕微鏡でさまざまな小さな自然物を観察し、それをスケッチとして記録しました。1665年に発刊された『顕微鏡図譜』(Micrographia)に掲載したコルクのスケッチが修道院の小部屋cellに似ているというのでこの構造をCellと名付けたのが細胞という生物用語の始まりです。実はコルクで見えていたのは死んだ組織に残った細胞壁であり現在の概念からは細胞ではないのですが、とにもかくにも生物のなかに小部屋があるとの意識が生まれてきたわけです(注1)。
話がまた少々それますが、かの時代の偉大な自然哲学者は実に多才であり、このフックは「弾性に関するフックの法則」のフックと同一人物というから驚きです。人柄的に問題ありとも言われているフックですが、今ならノーベル賞を医学生理学と物理学でダブル受賞ものですよ、これは。
Cellという生物学用語の創造から、細胞が生物の基本単位であるという認識までには一世紀以上の時間を要しています。1805年にオーケン(Oken)が全ての生物は細胞から成り立つと提唱しました。そして、多くの観察結果を携えて1838年に発表されたシュライデン(Schleiden)による 植物における説と1839年にシュワン(Schwann)が主に動物細胞に対して提唱した説をもって細胞説が打ち立てられたと考えられています。シュワンは、「生物は全て細胞と細胞から放出される物質から形成されており、細胞は独立に生きている、しかしこの独立性は生物全体として生きている状態に依存する」と考え、細胞の能力を、(1)構成成分が結合して細胞の構造を完成させる能力と(2)化学変化を引き起こす能力に分類しました。この考えは現代の生命科学水準に照らし合わせてみても頷ける卓見と思います。
生体膜
細胞説の確立に従い、「単位である細胞はバリアによって区切られているはずである。そのバリアたる細胞表層の実体は何だろう?」という問題意識が立ち上がります。
そして、いろいろなことがわかり始めていきます。有名なところを年代順に列挙すると、
膜透過性は透過物質の脂溶性と相関していることから、隔壁を形成する膜は大部分脂質であろうと指摘される(1895年Overton)。
赤血球から抽出した脂質を水面に密に分散させるとその面積は、光学顕微鏡で見積もった赤血球表面積の約二倍になるとの観察から、赤血球膜の脂質は二重分子層又は二分子膜構造であると提唱される(1925年 Gorter and Grendel)。
生体膜はリン脂質二重層phospholipid bilayerがタンパク質で覆われた構造をしているというモデルが提唱される(1935年 Davson-Danielli)。
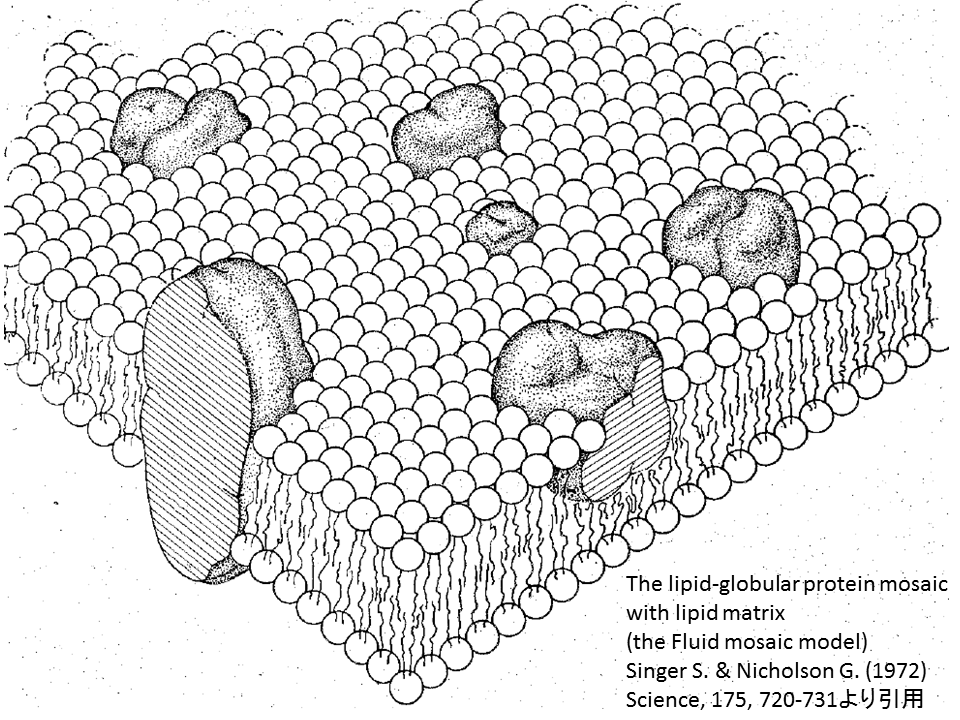
しかし、脂質層とタンパク質層が分離しているモデルでは、うまく説明できない観察も多々ありました。それから約40年の間に生体膜の解析情報も蓄積していきます。例えば、膜脂質二重層の中央部分ではがしたサンプルの電子線顕微鏡像を観察するフリーズエッチングfreeze etching電子線顕微鏡解析により、膜タンパク質には表在性(peripheral)のものだけでなく脂質層を貫く内在性(integral)のものも多くあることがわかってきました。これらの情報を踏まえて、画期的なモデルが1972年、米国のシンガーSinger とニコルソンNicholsonから提示されました。これが、生体膜の流動モサイクモデルfluid mosaic modelです。
流動モサイクモデルでは、リン脂質二重層によって作られる粘性基盤にタンパク質が表面接着したり、種類によっては貫通して、2次元的には流動的に動き回っているとしています。そして、これら生体膜の特性を、熱力学のような物理原則に沿っていると説明しつつ、視覚的にも明確なポンチ絵で提示しました。おそらく1970年代初頭において、生体膜に関心のある者たちの多くが、断片的に頭に描きながらも全体像を説明するには至らない状況にあり、このモデルを一目見るなり、「漠然と感じていたことは、まさにこういうようなことなんだよ!」と即座に受け入れたのではないかと想像します。
生体膜の流動モサイクモデルは、現時点でも本質的に正しいと受け入れられています。しかし、オリジナルの流動モサイクモデルでは、脂質分子の多様性の意義はあまり考慮されておらず、脂質分子は基盤平面上に一様に分布しているような描き方をされています。この点は、1990年代初頭から脂質ラフトという概念の登場とともに見直され、生体膜では、特定の種類の脂質分子が他の分子に比べてお互いに寄り添っている確率が高いというように、同一膜上でありながらも脂質分子の分布には偏りがあることがわかってきています。
化学反応が起きるには多くの場合、2つの分子が出会うことが必要です。決まった数の2種類の分子が出会う頻度を、それら分子が3次元空間に分散している場合とその空間を囲む2次元表面上で動き回っている場合で比較すると、後者の方で著しく高くなることが計算上予測されます。この性質一つ考えても、細胞中における生体膜が化学反応場としても意義深い特性を備えていることが想像できます。一説には、細胞中で起こる生化学反応の70%は生体膜上およびその近傍で起こっているそうです。
ヒトの成熟赤血球は核を失っており、分裂能も持っていません。よって、生きている細胞とはみなされないのが普通です。赤血球は、全身を駆け巡って酸素・二酸化炭素交換を行っており、顕微鏡で観察すれば、その姿はつやつやイキイキしていて、あたかも生きた細胞のように見えます。このように分裂能を完全に失いながらもエネルギー代謝をして細胞としての機能を全うしていれば生きた細胞に準じたものと感じられます。そのためには、細胞内部が秩序高い状態に保たれる必要があり、それには上述および次項で述べる特性を持つ生体膜で覆われていることが不可欠となります。
以上のような経緯で、生体膜は細胞が細胞たりえる最も基盤的な構造体と今では広く認識されるようになっています。
少々きざな言い方をしますと、「生体膜は生命の動的秩序を作り出す揺りかご」といえましょう。
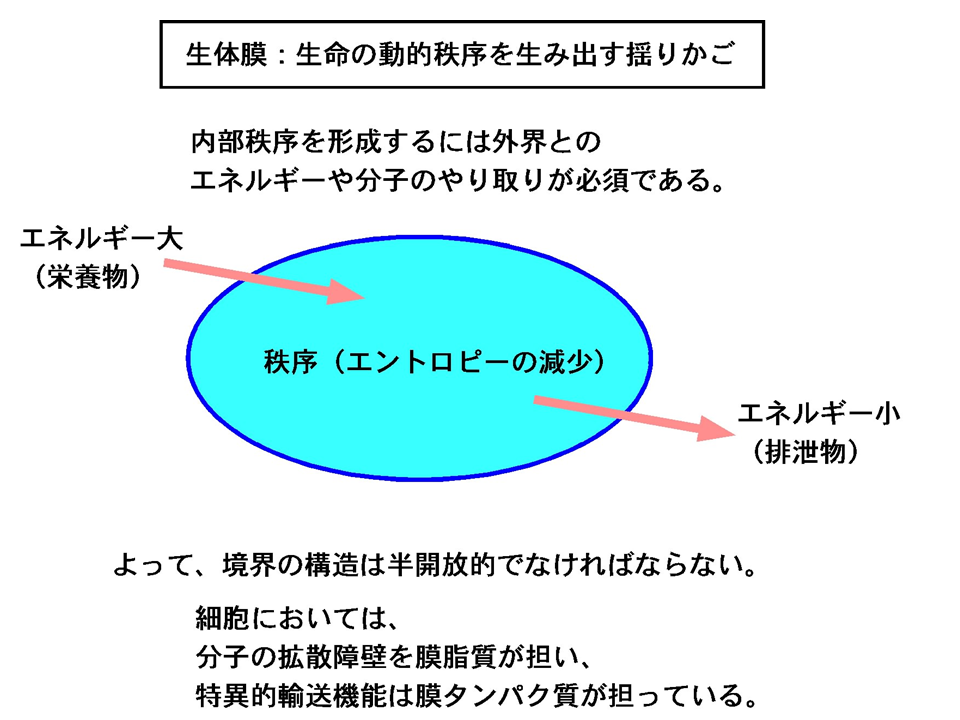
生体膜の基盤を形成する脂質分子
生体膜を構成する脂質には多様な機能があります(これらさまざまな機能については別の機会に記載したいと思います)。しかし、生命進化を考えるとき、膜脂質のもっとも重要な機能は、細胞内外の隔てる境界を形成するということにあると私は思います。その機能を発揮するうえで膜脂質は驚くべき分子特性molecular characteristicsをもっています。
先ず、膜脂質は、疎水性相互作用によって自律的に水と分離しつつ、二重層を形成することで脂質シートの内外の表面がともに親水的という構造をとります。脂質の合成にはATPといった生物学的エネルギーの消費を必要とするものの、一度出来上がった脂質分子には水環境下で自律的に袋状の構造体を作りえるような性質を持っているということになります。
水からの脂質の分離は疎水性相互作用で起こりますので、膜シートを形成するのに膜脂質分子同士の共有結合は必要ないということも大きな意味を持ちます。これによって膜の高い流動性が確保されるだけでなく、膜が変形する際に脂質同士の結合を再構築させる必要もないというエネルギー節約システムが可能になっています。共有結合のネットワークで成り立つ生体膜を想像してみてください。そこでは、細胞分裂やその他のことで頻繁に起こっている膜の融合や分裂の際に、いちいち膜中の共有結合を切り離して再結合させなければならず、それには相応のATP消費を伴うということになります。そのような膜は、強度的には優れているでしょうが、柔軟性とエネルギー効率の面で脂質膜よりも格段落ちるものになるでしょう。
もう一つ強調したいのは、電荷を持つ物質に対してリン脂質二重層が持つ優れたバリア特性です。システムには内外の境界が存在し、境界では内と外とのエネルギーや物質の出入りを適切に行うことが動的なシステムには必須と先述しました。必要なものは取り込み、捨てるべきものは出すという機能は、生体膜においてタンパク質が担っています。ところで、ものやヒトの出入りをちゃんと管理する門番がいても、周囲にちゃんとした壁も柵もないような場所に城という役割は果たせそうもありません。似たようなことは全てのシステムに当てはまります。エネルギーや物質の出入りを適切に行うには、必要ないものは取り込まない、捨てるべきでないものは出さない、というバリア機能がシステムの境界に備わっていることが前提なのです。そして、このバリアという側面は、生体膜において主に脂質が担っています。
人工的なリン脂質膜を用いた観察によると、Na+やK+といった主要イオンはほとんど通過できません。プロトンH+に対してもかなりのバリア特性を示します。親水性物質であっても電荷を持っていない物質(例えばグリセロール)はある程度通過させ、水分子はよく通します。
Na+やK+の形質膜内外濃度差は、神経伝達には必須です。また、膜内外の電位差とプロトン濃度差は、葉緑体での光合成photosynthesisやミトコンドリアでの酸化的リン酸化oxidative phosphorylationによってATPが合成される際に必須です。このことを考えただけでも、イオン不透過性を膜にもたらす脂質のような生体分子が出現せずにいたら、生命は進化できなかったであろうと思います。
注1)PhylosophyやScienceという西洋の言葉をそれぞれ哲学、科学という新しい日本語を作って和訳したのは江戸時代終期から明治初期に活躍した啓蒙家の西周(ニシ・アマネ)であることはわりとよく知られています。一方、細胞という日本語は誰がいつ作ったのかは生命科学系の研究者内でもほとんど知られていないようであり、私自身も知りませんでした。そこでネット検索して調べてみると、江戸時代後期の蘭学者である宇田川榕庵(ウダガワ・ヨウアン)がCell (蘭学たるオランダ語ならCel)の和訳に細胞という言葉を当てたとのこと。 江戸時代にすでに細胞という生物用語が生み出されていたのですね。 (注1は2018年8月21日追記)
花田賢太郎(感染研 品質保証・管理部、細胞化学部併任)
(2012年12月10日)(2021年4月1日 所属更新)
V. Vero細胞の物語 ~その樹立からゲノム構造の決定、そして未来へ~
その他の記事
1.生命、細胞、生体膜(このページ)
2. スフィンゴ脂質およびセラミドの命名事始め(外部サイトへリンク)
3. セラミド研究史概略(外部サイトへリンク)
細胞化学部 第二室(生体膜解析室)
細胞化学部の第二室では、哺乳動物細胞株における遺伝学的手法を用いた宿主因子の探索に関する研究、及び感染症に関与する生体膜糖鎖・脂質の代謝や細胞内輸送に関する研究を行っています。
スタッフ
室長 山地 俊之
博士研究員 本間 悠太(学振)
実習生 朝平 凌矢(日本大学理工学部B4)
実習生 柴田 麿(日本大学理工学部B4)
研究テーマ
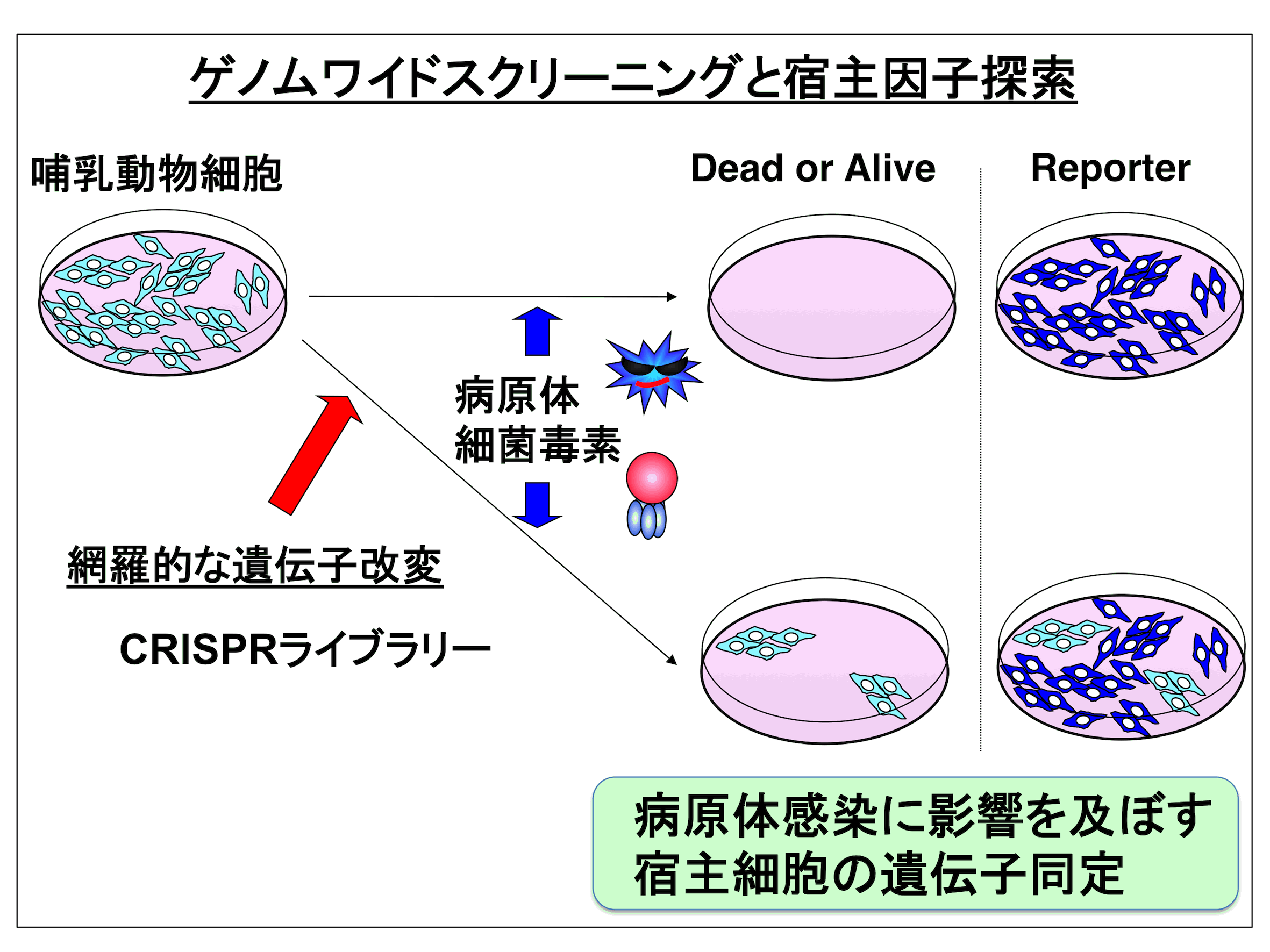
1. ゲノムワイドライブラリーを用いた宿主因子探索
ウイルスや細菌毒素は宿主細胞に作用することで病原性を示します。当室ではこれら病原体感染に影響を及ぼす宿主因子を探索する手段として、哺乳動物細胞における遺伝学的手法を積極的に取り入れています。以前よりRNA interference(RNAi)法や遺伝子トラップ法、cDNAライブラリーによる発現クローニング法を用いたスクリーニングが行われてきましたが、これらに加え近年のゲノム編集法の進歩に伴い、様々な哺乳動物細胞株において網羅的な遺伝子ノックアウト細胞群が作製できる時代となりました。我々はゲノム編集法の1つCRISPR/Cas9システムのゲノムワイドライブラリーを導入し、哺乳動物細胞を用いたスクリーニング系のプラットフォームを構築することで、様々な病原体感染における宿主因子探索を行っています(所内外で共同研究実施中!)。
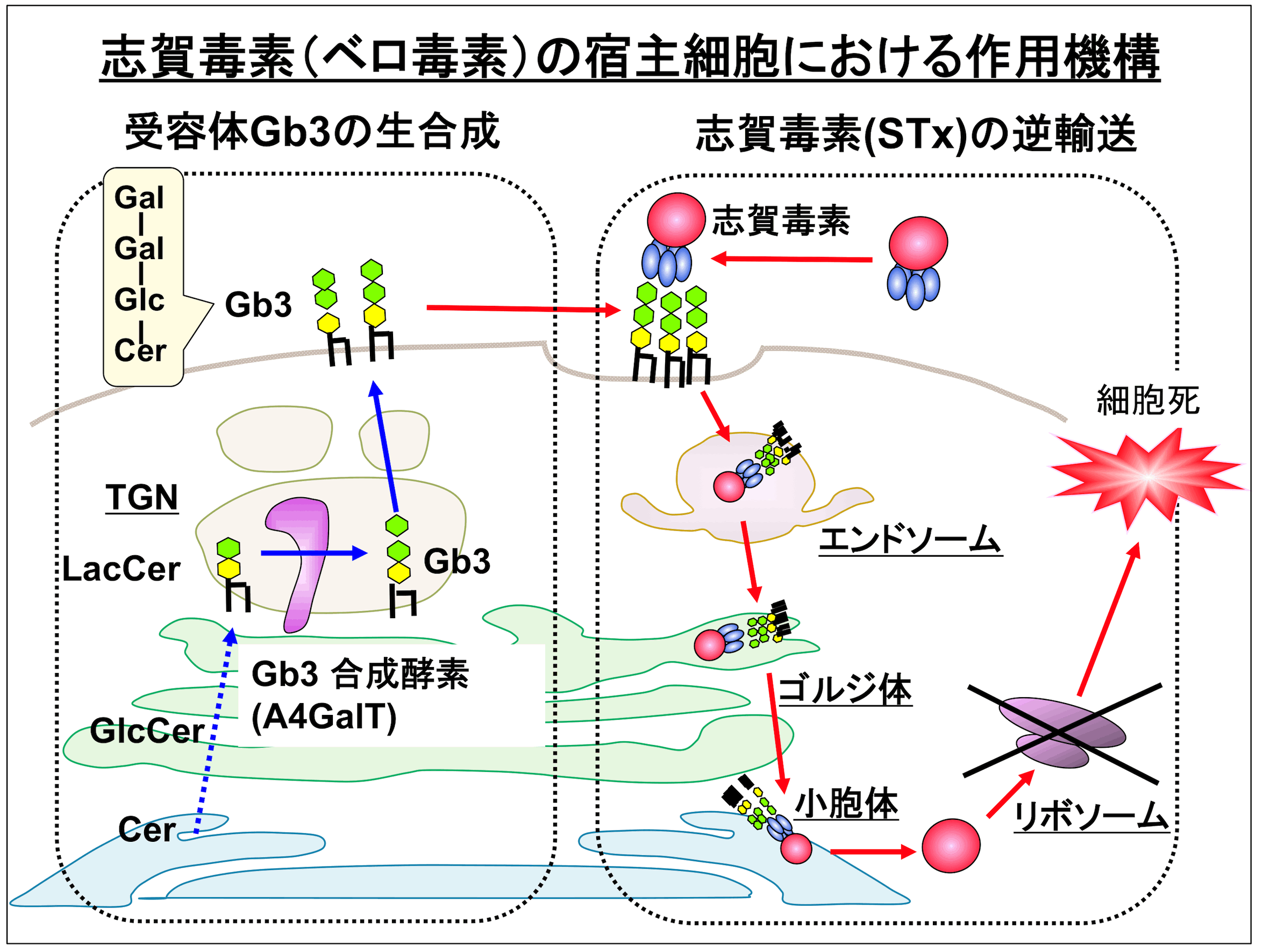
2. 志賀毒素による細胞死に対し影響を及ぼす宿主因子の探索
宿主因子探索の1つとして、志賀毒素を標的とした研究を行っています。志賀毒素は腸管出血性大腸菌が産生する外毒素であり、別名ベロ毒素とも呼ばれています。非常に毒性が強く、出血性の下痢をはじめ溶血性尿毒症症候群や脳炎と行った重篤な症状を引き起こすこともあります。この毒素は細胞表面のスフィンゴ糖脂質の一種Gb3に結合後、エンドソーム-ゴルジ体-小胞体-細胞質内へと逆輸送され、リボソームを不活化することで細胞死をもたらします。この毒素を用いて上記の遺伝学的スクリーニングを行うことで、(a) 志賀毒素-Gb3複合体の逆輸送に関する新規因子、(b) 受容体Gb3の生合成に影響する新規因子 (スフィンゴ糖脂質生合成酵素の活性や細胞内分布に影響する因子、及びスフィンゴ糖脂質輸送に関する因子)の探索を行っています。
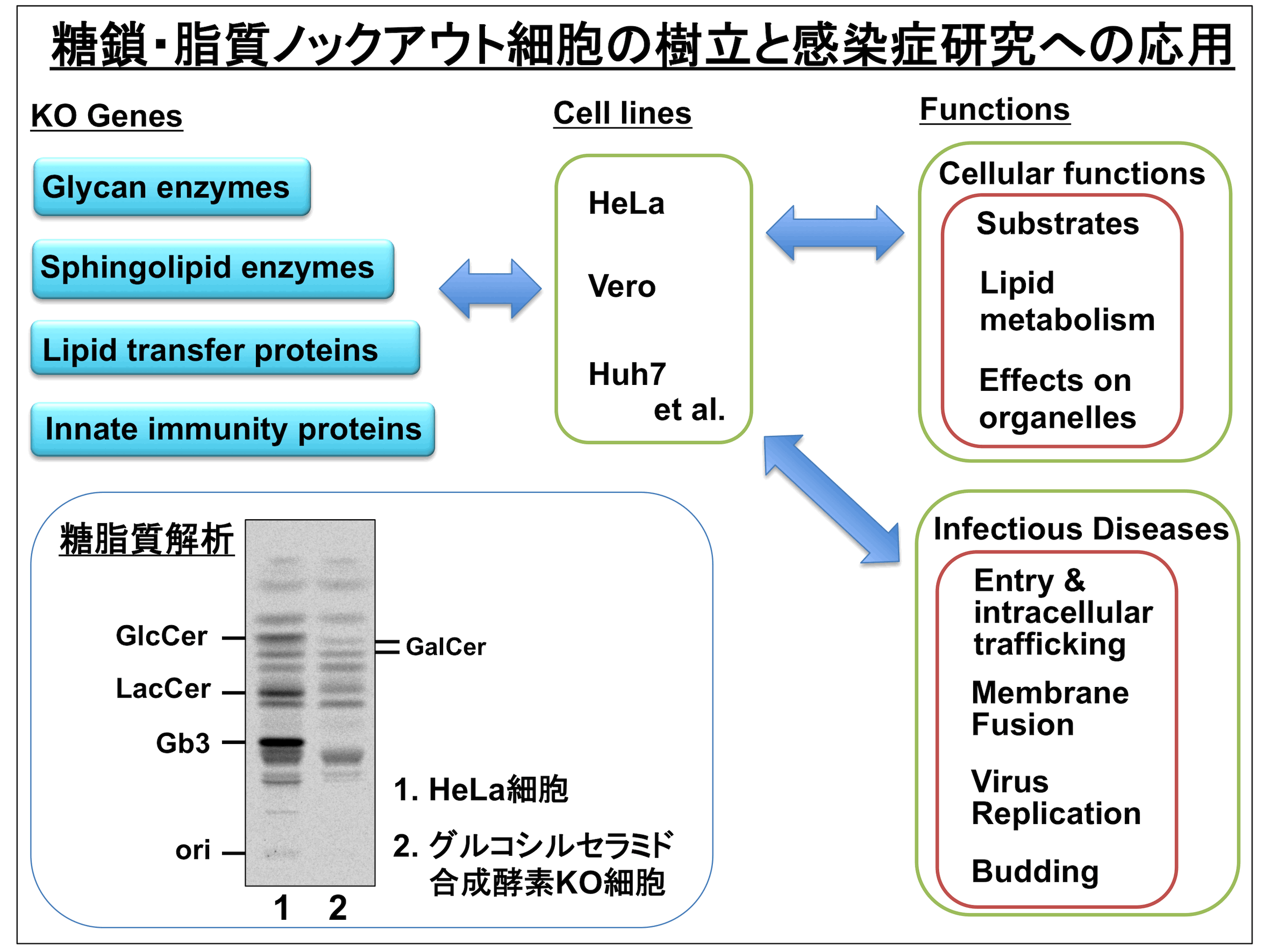
3. 糖鎖・脂質の代謝研究と感染症研究への応用
哺乳動物細胞の生体膜には様々な糖鎖や脂質が存在しており、上記の志賀毒素をはじめとして様々な病原体や細菌毒素の受容体として、またウイルス複製に必要な成分として関与しています。これら糖鎖や脂質の生合成酵素はほぼ同定されていますが、多種類存在する酵素が理路整然と糖鎖や脂質を作り上げるためには、単に酵素の発現量だけでなく基質と生合成酵素両方の輸送や細胞内分布が正しく制御されていることが重要です。そこで遺伝学的手法を用いたスクリーニングにより、糖鎖や脂質の代謝に影響を及ぼす新規因子の同定を目指しています。またスフィンゴ糖脂質をはじめとする、様々な糖鎖・脂質関連遺伝子、及び自然免疫関連遺伝子の遺伝子破壊細胞を作製し、細胞レベルにおける病原体感染への影響について検討しています。
大学院生募集中!
研究室にご興味がある方は山地 (tyamaji at nih.go.jp) までメールください。
(atは@にしてください)
Copyright 2018, Toshiyuki Yamaji, NIID, Japan
花田業績リスト 2024.3.22更新
・英文論文のみ記載(断りのない限り査読有)
・各論文の責任著者(corresponding author)には名前の左肩に*印をつけた。
・各論文のDigital Object Identifier (DOI)もわかる範囲で加えた。
・Open access(誰でもネットで全文ダウンロード可能)なものはなるべくURLを記載した。
・Google Scholarで提示された総引用数=13,342、h-index= 64; i10-Index=150 (2024.3.22.時点)
2024年
- *Mizuike A,, Hanada K (2024) DGARM/C10orf76/ARMH3 for ceramide transfer zone at the endoplasmic reticulum-distal Golgi contacts, CONTACT, 7, article 25152564241239443. (invited review article) open access: https://journals.sagepub.com/doi/10.1177/25152564241239443
2023年
- *Someya K, Okemoto-Nakamura Y, Kurata T, Saito N, Itamochi M, Otsuki N, Hanada K, Takeda M (2023) Establishment of Measles virus receptor-expressing Vero cells lacking functional poliovirus receptors, Microbiol Immunol, 67, 166-170. doi: 10.1111/1348-0421.13047
- *Goto A, Hanada K: Protocols for casein kinase 1γ3 CSNK1G3 gene knockout and recombinant gene expression in cultured mammalian cells, STAR Protocols, 4, article 102251, 2023. Open access: https://doi.org/10.1016/j.xpro.2023.102251
- Charlotte Gehin, Museer A. Lone, Winston Lee, Laura Capolupo, Sylvia Ho, Adekemi Adeyemi, Erica H. Gerkes, Alexander P.A. Stegmann, Estrella López-Martín, Eva Bermejo-Sánchez, Beatriz Martínez-Delgado, Christiane Zweier, Cornelia Kraus, Bernt Popp, Vincent Strehlow, Daniel Gräfe, Ina Knerr, Eppie Jones, Stefano Zamuner, Luciano A. Abriata, Vidya Kunnathully, Brandon E. Moeller, Anthony Vocat, Samuel Rommelaere, Jean-Philippe Bocquete, Evelyne Ruchti, Greta Limoni, Marine Van Campenhoudt, Samuel Bourgeat, Petra Henklein, Christian Gilissen, Bregje W. van Bon, Rolph Pfundt, Marjolein Willemsen, Jolanda Schieving, Emanuela Leonardi, Fiorenza Soli, Alessandra Murgia, Hui Guo, Qiumeng Zhang, Kun Xia, Christina R. Fagerberg, Christoph P. Beier, Martin J. Larsen, Irene Valenzuela, Paula Fernández-Álvarez, Shiyi Xiong, Robert Śmigiel, Vanesa López-González, Lluís Armengol, Manuela Morleo, Angelo Selicorni, Annalaura Torella, Moira Blyth, Nicola Cooper, Valerie Wilson, Renske Oegema, Yvan Herenger, Aurore Garde, Ange-Line Bruel, Frederic Tran Mau-Them, Alexis B.R. Maddocks, Jennifer M. Bain, Musadiq A. Bhat, Gregory Costain, Peter Kannu, Ashish Marwaha, Neena L. Champaigne, Michael J. Friez, Ellen B Richardson, Vykuntaraju K. Gowda, Varunvenkat M. Srinivasan, Yask Gupta, Tze Y. Lim, Simone Sanna-Cherchi, Bruno Lemaitre, Toshiyuki Yamaji , Kentaro Hanada, John E. Burke, Ana Marjia Jaksic, Brian D. McCabe, Paolo De Los Rios, *Thorsten Hornemann, *Giovanni D’Angelo, and *Vincenzo A. Gennarino: CERT mutations perturb human development by disrupting sphingolipid homeostasis, J Clin Invest, 133, e165019, 2023. (Gehin C, Lone MA, and Lee W are co-first authors) Open access: 10.1172/JCI165019
- Mizuike A, Sakai S, Katoh K, Yamaji T, *Hanada K: The C10orf76-PI4KB axis orchestrates CERT-mediated ceramide trafficking to the distal Golgi, J Cell Biol, 222, e202111069, 2023. Open access :https://rupress.org/jcb/article/222/7/e202111069/214116
2022年
- *Sugiki T, Lee Y-H, Alsanousi N, Murata K; Kawamura I, Fujiwara T, Hanada K, *Kojima C (2022) A hybrid strategy combining solution NMR spectroscopy and isothermal titration calorimetry to characterize protein-nanodisc interaction, Anal Biochem, 639, article 114521. (T.S. & Y.-H. L. are co-first authors) Open access: https://doi.org/10.1016/j.ab.2021.114521
- *Hanada K, Sakai S, Kumagai K (2022) Natural ligand-mimetic and nonmimetic inhibitors of the ceramide transport protein CERT, Int J Mol Sci, 23, article 2098. (invited review article) Open access: https://doi.org/10.3390/ijms23042098
- Konishi K, Yamaji T, Sakuma C, Kasai F, Endo T, Kohara A, *Hanada K, *Osada N (2022) Whole-genome sequencing of Vero E6 (VERO C1008) and comparative analysis of four Vero cell sublines, Front Genetics, 13, article 801382. Open access: https://www.frontiersin.org/articles/10.3389/fgene.2022.801382/full
- Fujita J, Taniguchi M, Hashizume C, Ueda Y, Sakai S, Kondo T, Hashimoto-Nishimura M, Hanada K, Kosaka T, *Okazaki T (2022) Nuclear ceramide is associated with ATM activation in the neocarzinostatin-induced apoptosis of lymphoblastoid cells, Mol Pharmacol, 101, 322-333. Doi: 10.1124/molpharm.121.000379
- Shimasaki K, *Kumagai K, Sakai S, Yamaji T, *Hanada K (2022) Hyperosmotic stress induces phosphorylation of CERT and enhances its tethering throughout the endoplasmic reticulum, Int J Mol Sci, 23, article 4025. Open access: https://doi.org/10.3390/ijms23074025
- *Konan K, Ogbamikael SA, Yager E, Yamaji T, Cerone J, Monaco-Brown M, Barroso M, Hanada K (2022) Modulation of Zika virus replication via glucosylceramide synthase and glycosphingolipids, Virology, 572, 17-27. Doi: 10.1016/j.virol.2022.03.014
- *Hanada K (2022) Dysregulation of a lipid transfer protein linked to brain disorders, LIPID NEWS, ASBMB TODAY, April 12, 2022. Open access: https://www.asbmb.org/asbmb-today/science/041222/dysregulation-of-a-lipid-transfer-protein-linked-t (invited news article, non-peer-reviewed)
- Kobayashi J, *Arita M, Sakai S, Kojima H, Senda M, Senda T, Hanada K, *Kato R (2022) Ligand recognition by the lipid transfer domain of human OSBP is important for enterovirus replication, ACS Infect Dis, 8, 1161–1170. Doi:10.1021/acsinfecdis.2c00108
- Goto A, Sakai S, Mizuike A, Yamaji T, *Hanada K (2022) Compartmentalization of casein kinase 1 γ CSNK1G controls the intracellular trafficking of ceramide, iScience, 15, article 104624. Open access: https://doi.org/10.1016/j.isci.2022.104624.
- Goto A, Egawa D, *Tomishige N, Yamaji T, Kumagai K, *Hanada K (2022) Involvement of a cluster of basic amino acids in phosphorylation-dependent functional repression of the ceramide transport protein CERT, Int J Mol Sci, 23, article 8576. (A.G. and D.E. are co-first authors) Open access: https://doi.org/10.3390/ijms23158576
- *Saito K, Shimasaki K, Fukasawa M, Suzuki R, Okemoto-Nakamura Y, Katoh K, Takasaki T, Hanada K (2022) Establishment of Vero cell lines persistently harboring a yellow fever virus 17D subgenomic replicon, Virus Res, 322, article 198935. doi: 10.1016/j.virusres.2022.198935
- *Mori Y, Sakata M, Sakai S, Okamoto T, Nakatsu Y, Taguwa S, Otsuki N, Maeda Y, Hanada K, Matsuura Y, Takeda M (2022) Membrane sphingomyelin in host cells is essential for nucleocapsid penetration into the cytoplasm after hemifusion during rubella virus entry, mBio, 13, e01698-22. Open access: https://doi.org/10.1128/mbio.01698-22
- Shirasago Y, Fukazawa H, Nagase S, Shimizu Y, Wakita T, Suzuki T, Tani H, Kondoh M, Kuroda T, Yasuda S, Sato Y, Hanada K, *Fukasawa M (2022) A single mutation in the E2 glycoprotein of hepatitis C virus broadens the claudin specificity for its infection, Sci Rep, 12, article 20243. Open access: https://doi.org/10.1038/s41598-022-23824-3
- *Kumagai K, Sakai S, Ueno M, Kataoka M, Kobayashi S, *Hanada K (2022) Chlamydial infection-dependent synthesis of sphingomyelin as a novel anti-chlamydial target of ceramide-mimetic compounds, Int J Mol Sci, 23, article 14697. Open access: https://doi.org/10.3390/ijms232314697.
(2021年までの論文業績に関しては下の「・次へ>>」をクリックして下さい)
花田研究業績(このページ)
その他の記事
2. スフィンゴ脂質およびセラミドの命名事始め(外部サイトへリンク)
2021年
- Shimizu Y, Shinoda T, Shirasago Y, Kondoh M, Shinya N, Hanada K, Yagi K, Suzuki T, Wakita T, Kimura-Someya T, Shirouzu M, and *Fukasawa M (2021) Generation and characterization of single-chain variable fragment occludin-binding antibodies to prevent hepatitis C virus infection, FEBS Let, 595, 220-229. doi: 10.1002/1873-3468.13975.
- Ogawa M, Shirasago Y, Tanida I, Kakuta S, Uchiyama Y, Shimojima M, Hanada K, Saijo M, and *Fukasawa M (2021)Structural basis of antiviral activity of caffeic acid against severe fever with thrombocytopenia syndrome virus, J Infect Chemother, 27, 397-400. doi: 10.1016/j.jiac.2020.10.015.
- *Rizzo R, Russo D, Kurokawa K, Sahu P, Lombardi B, Supino D, Zhukovsky M, Vocat A, Pothukuchi P, Kunnathully V, Capolupo L, Boncompain G, Vitagliano C, Marino FZ, Aquino G, Montariello D, Henklein P, Mandrich L, Botii G, Clausen H, Mandel U, Yamaji T, Hanada K, Budillon A, Perez F, Parashuraman S, Hannun YA, Nakano A, Corda D, *D’Angelo G and *Luini A (2021) Golgi maturation-dependent glycoenzyme recycling controls glycosphingolipid biosynthesis and cell growth via GOLPH3. EMBO Journal. 2021, 40, e107238, Open access: https://www.embopress.org/doi/epdf/10.15252/embj.2020107238
- Okemoto-Nakamura Y, Someya K, Yamaji T, Saito K, Takeda M, and *Hanada K (2021) Poliovirus-nonsusceptible Vero cell line for the World Health Organization global action plan, Sci Rep, 11, article 6746. Open access: https://www.nature.com/articles/s41598-021-86050-3 (Y.O.-N.. and K.S. are co-first authors)
- Sakuma C, Sekizuka T, Kuroda M, Hanada K, and *Yamaji T (2021) Identification of SYS1 as a host factor required for Shiga toxin-mediated cytotoxicity in Vero cells, Int J Mol Sci, 22, article 4936. Open access: https://doi.org/10.3390/ijms22094936
- Yamanaka A, Matsuda M, Okabayashi T, Pitaksajjakul P, Ramasoota P, Saito K, Fukasawa M, Hanada K, Matsuura T, Muramatsu M, Shioda T, and *Suzuki R (2021) Seroprevalence of flavivirus neutralizing antibodies in Thailand by high-throughput neutralization assay: Endemic circulation of Zika virus before 2012, mSphere, 6, e00339-21. Open access: https://doi.org/10.1128/mSphere.00339-21 (A.Y. & M.M. are co-first authors)
- *Furuichi K, Hiraoka M, Hanada K, Fujiwara T, and *Kojima C (2021) Sequence requirements of the FFAT-like motif for specific binding to VAP-A are revealed by NMR, FEBS Lett, 595, 2248-2256. doi: 10.1002/1873-3468.14166.
- Tamura N, Sakai S, Martorell L, Colomé R, Mizuike A, Goto A, *Ortigoza-Escobar JD, and *Hanada K (2021) Intellectual disability-associated mutations in the ceramide transport protein gene CERT1 lead to aberrant function and subcellular distribution, J Biol Chem, 297, article 101338. Open access: https://doi.org/10.1016/j.jbc.2021.101338
2020年
- Tachida Y, Kumagai K, Sakai S, Ando S, *Yamaji T, and *Hanada K (2020) Chlamydia trachomatis-infected human cells convert ceramide to sphingomyelin without sphingomyelin synthases 1 and 2. FEBS Let, 594, 519-529. doi.org/10.1002/1873-3468.13632
- *Hanada K (2020) Organelle contacts: sub-organelle zones to facilitate rapid and accurate inter-organelle trafficking of lipids.Traffic, 21, 189-196. doi.org/10.1111/tra.12716 (invited commentary)
- Ueno M, Miyoshi N, Hanada K, and *Kobayashi S (2020) Three-component, one-pot tandem Sonogashira/Suzuki–Miyaura coupling reactions for the synthesis of a library of ceramide-transport protein inhibitors designed in silico, Asia J Org Chem, 9, 267-273. DOI: 10.1002/ajoc.201900689
- *Saito K, Fukasawa M, Shirasago Y, Suzuki R, Osada N, Yamaji T, Wakita T, Konishi E, and Hanada K (2020) Comparative characterization of flavivirus production in two cell lines: Human hepatoma-derived Huh7.5.1-8 and African green monkey kidney-derived Vero. PLoS ONE, 15, e0232274. https://doi.org/10.1371/journal.pone.0232274
- Morimoto K, Suzuki N, Tanida I, Kakuta S, Furuta Y, Uchiyama Y, Hanada K, Suzuki Y, *Yamaj T (2020) Blood group P1 antigen-bearing glycoproteins are functional but less efficient receptors of Shiga toxin than conventional glycolipid-based receptors, J Biol Chem, 295, 9490-9501. doi: 10.1074/jbc.RA120.013926.
- Goto A, Mizuike A, and *Hanada K (2020) Sphingolipid metabolism occurring at the ER-Golgi contact zone and its impact on membrane trafficking, CONTACT, 3, article 2515256420959514. Open access: 10.1177/2515256420959514 (invited review article) (A.G. and A.M. are co-first authors)
- Gewaid H, Aoyagi H, Arita M, Watashi K, Suzuki R, Sakai S, Kumagai K, Yamaji T, Fukasawa M, Kato F, Hishiki T, Mimata A, Sakamaki Y, Ichinose S, Hanada K, Muramatsu M, Wakita T, and *Aizaki (2020) Sphingomyelin is essential for the structure and function of the double-membrane vesicles in the viral RNA replication factories, double-membrane vesicles, J Virol, 94, e01080-20. https://doi.org/10.1128/JVI.01080-20.
- Kawamoto M, Yamaji T, Saito K, Shirasago Y, Satomura K, Endo T, Fukasawa M, *Hanada K, and *Osada N (2020) Identification of characteristic genomic markers in human hepatoma HuH-7 and Huh7.5.1-8 cell lines, Frontier in Genetics, 111, Article 546106. Open access: https://doi.org/10.3389/fgene.2020.546106
- Murakami H, Tamura N, Enomoto Y, Shimasaki K, *Kurosawa K, and *Hanada K (2020) Intellectual disability-associated gain-of-function mutations in CERT1 that encodes the ceramide transport protein CERT, PLoS ONE, 15, e0243980. (H.M. and N.T. are co-first authors. K.K. and K.H. are co-correspondence) Open access: https://doi.org/10.1371/journal.pone.0243980
2019年
- *Yamaji T, Sekizuka T, Tachida Y, Sakuma C, Kuroda M, and Hanada K (2019) A CRISPR screen identifies LAPTM4A and TM9SF proteins as glycolipid-regulating factors, iScience, 11, 409-424. doi.org/10.1016/j.isci.2018.12.039.
- Nakao N, Ueno M, Sakai S, Egawa D, Hanzawa H, Kawasaki S, Kumagai K, Suzuki M, *Kobayashi S, and *Hanada K (2019) Natural ligand-nonmimetic inhibitors to the lipid transfer protein CERT, Commun Chem, 2, article 20.doi: 10.1038/s42004-019-0118-3 (N.N., M.U., and S.S. are co-first authors) (open access: https://www.nature.com/articles/s42004-019-0118-3)
- Shirasago Y, Inamori Y, Suzuki T, Tanida I, Suzuki T, Sugiyama K, Wakita T, Hanada K, and *Fukasawa M (2019) Inhibition mechanisms of hepatitis C virus infection by caffeic acid and tannic acid, Biol Pharm Bull, 42, 770. doi:10.1248/bpb.b18-00970 (a Highlighted paper selected by Editor-in-Chief).
- Shimizu Y, Shirasago Y, Suzuki T, Hata T, Kondoh M, Hanada K, Yagi K, and *Fukasawa M (2019) Characterization of monoclonal antibodies recognizing each extracellular loop domain of occluding, J Biochem, 166, 297-308. doi: 10.1093/jb/mvz037
- *Yamaji T, Hanamatsu H, Sekizuka T, Kuroda M, Ohnishi M,Furukawa J, *Yahiro K,, and Hanada K (2019) A CRISPR screen using subtilase cytotoxin identifies SLC39A9 as a glycan-regulating factor, iScience, 15, 407-420. doi: 10.1016/j.isci.2019.05.005
- *Kumagai K, and *Hanada K (2019) Structure, functions, and regulation of CERT, a lipid-transfer protein for the delivery of ceramide at the ER-Golgi membrane contact sites, FEBS Let, 593, 2366-2377. https://doi.org/10.1002/1873-3468.13511 (invited review)
- *Osawa T, *Shimamura T, Saito K, Hasegawa Y, Ishii N, Nishida M, Kondo A, Anwar M, Tsuchida R,Hino S, Sakamoto A, Igarashi K, Saitoh K, Kato K, Endo K, Yamano S, Kanki Y, Matsumura Y, Minami T, Tanaka T, Anai M, Wada Y, Wanibuchi H, Hayashi M, Hamada A, Yoshida M, Yachida S, Nakao M, Sakai J, Aburatani H, Shibuya M, Hanada K, Miyano S, *Soga T, and *Kodama T (2019) Phosphoethanolamine accumulation protects cancer cells under glutamine starvation through downregulation of PCYT2. Cell Rep, 29, 89-103. doi.org/10.1016/j.celrep.2019.08.087
- *Okemoto-Nakamura Y, Tanida I, Yamaji T, *Hanada K, and Hagiwara K (2019) A PRNP-disrupted human neuroblastoma cell line and its stable transformants expressing human prion variants. BPB Rep, 2, 73-79. (Open access: https://www3.e-kenkyu.com/bpb-reports-online-journal/uploads/manuscript/file/38/2_73.pdf).
2018年
- Sakuma C, Sekizuka T, Kuroda M, Kasai F, Saito K, Ikeda M, Yamaji T, *Osada N, and *Hanada K (2018) Novel endogenous simian retroviral integrations in Vero cells: implications for quality control of a human vaccine cell substrate, Sci Rep, 8, 644. (C.S. and T.S. are co-first authors. N.O. and K.H. are co-correspondence) doi: 10.1038/s41598-017-18934-2. (Open access: https://www.nature.com/articles/s41598-017-18934-2)
- Shimasaki K, Watanabe-Takahash M, Umeda M, Funamoto S, Saito Y, Noguchi N, Kumagai K, Hanada K, Tsukahara F, Maru Y, Shibata N, Naito M, and *Nishikawa K (2018) Pleckstrin homology domain of p210 BCR-ABL interacts with cardiolipin to regulate its mitochondrial translocation and subsequent mitophagy, Genes Cells, 23, 22-34. doi: 10.1111/gtc.12544.
- Otsuki N, Sakata M, Saito K, Okamoto K, Mori Y, *Hanada K, and *Takeda M (2018) Both sphingomyelin and cholesterol in the host cell membrane are essential for Rubella virus entry. J Virol, 92, e01130-17. doi: 10.1128/JVI.01130-17.(selected as Spotlight)
- Shimizu Y, Shirasago Y, Kondoh M, Suzuki T, Wakita T, Hanada K, Yagi K, and *Fukasawa M (2018) Monoclonal antibodies against occludin completely prevented hepatitis C virus infection in a mouse model, J Virol, 92, e02258-17. doi:10.1128/JVI.02258-17. (selected as Spotlight)
- Sugiki T, Egawa D, Kumagai K, Kojima C, Fujiwara T, Takeuchi K, Shimada I, *Hanada K, and *Takahashi H (2018) Phosphoinositide binding by the PH domain in ceramide transfer protein (CERT) is inhibited by hyperphosphorylation of an adjacent serine-repeat motif, J Biol Chem, 293, 11206-11217. (T.S. and D.E. are co-first authors. K.H. and H.T. are co-correspondence) doi: 10.1074/jbc.RA118.002465.
- Ikeda M, Satomura K, Sekizuka T, Hanada K, Endo T, *Osada N (2018) Comprehensive phylogenomic analysis reveals a novel cluster of simian endogenous retroviral sequences in Colobinae monkeys, Am J Primatol, e22882. doi: 10.1002/ajp.22882.
- *Hanada K (2018) Lipid-transfer proteins rectify inter-organelle flux and accurately deliver lipids at membrane contact sites, J Lipid Res, 59, 1341-1366. doi: org/10.1194/jlr.R085324 (Open access: http://www.jlr.org/content/59/8/1341.full.pdf+html) (invited review)
- *Saito K, Otsuki N, Takeda M, and Hanada K (2018) Liposome flotation assay for studying interactions between Rubella virus particles and lipid membranes, Bio-Protocol, 8(16), e2983.
- Shirasago Y, Fukazawa H, Aizaki H, Suzuki T, Suzuki T, Sugiyama K, Wakita T, Hanada K, Abe R, *Fukasawa M (2018) Thermostable hepatitis C virus JFH1-derived variant isolated by adaptation to Huh7.5.1 cells, J Gen Virol, 99(10), 1407-1417. doi: 10.1099/jgv.0.001117.
- *Kumagai K, Elwell CA, Andoh S, Engel JN, *Hanada K (2018) Both the N- and C- terminal regions of the Chlamydial inclusion protein D (IncD) are required for interaction with the pleckstrin homology domain of the ceramide transport protein CERT, Biochem Biophys Res Commun, 505(4), 1070-1076. doi: 10.1016/j.bbrc.2018.09.168.
2017年
- Tóth EA, Oszvald Á, Péter M, Balogh G, Osteikoetxea-Molnár A, Bozó T, Szabó-Meleg E, Nyitrai M, Derényi I, Yamaji T, Hanada K, Vígh L, and *Matkó J (2017) Nanotubes connecting B lymphocytes: High impact of differentiation-dependent lipid composition on their growth and mechanics, Biochim Biophys Acta, 1862, 991-1000. doi: 10.1016/j.bbalip.2017.06.011.
- *Hanada K (2017) Ceramide transport from the endoplasmic reticulum to the trans Golgi region at organelle membrane contact sites, in "Organelle Contact Sites: From Molecular Mechanism to Diseases" (Eds., Mitsuo Tagaya & Thomas Simmen), Series: Advances in Experimental Medicine and Biology, Vol.997, pp69-81, Springer. DOI: 10.1007/978-981-10-4567-7 (査読無し)
- *Hanada K, and Sugiki T (2017) In vitro assay to extract specific lipid types from phospholipid membranes using lipid-transfer proteins: a lesson from the ceramide transport protein CERT, in “Lipidomics” (Ed., Paul Wood), Series: Neuromethods, Vol.125, pp81-98, Springer. Doi: 10.1007/978-1-4939-6946-3_6.
- *Oh H, Shin J, Ato M, Ma X, Williams D, Han K, Kim YJ, Kang HG, Jung K, Hanada K, Ochiai M, Hug PV, Park S, and Ahn C (2017) Meeting report: The first meeting of the national control laboratories for vaccines and biologicals in the Western pacific in 2016, Osong Public Health Res Perspect, 8, 91-103. Doi: org/10.24171/j.phrp.2017.8.1.13
2016年
- *Yamaji T, Horie A, Tachida Y, Sakuma C, Suzuki Y, Kushi Y, and Hanada K (2016) Role of intracellular lipid logistics in the preferential usage of very long chain-ceramides in glucosylceramide, Int J Mol Sci,17, 1761. doi: 10.3390/ijms17101761
- Hernández-Tiedra S, Fabrias G, Salanueva IJ, Casas J, Dávila D, Montes RL, Antón Z, García-Taboada E, Salazar M, Lorente M, Nylandsted J, Armstrong J, López-Valero I, McKee CS, García-López R, Serrano A, Abad JL, Hanada K, Goñi FM, Guzmán M, Lovat P, Jäättelä M, Alonso A, and *Velasco G (2016) Dihydroceramide accumulation mediates cytotoxic autophagy of cancer cells via autolysosome destabilization, Autophagy,12, 2213-2229. doi: 10.1080/15548627.2016.1213927
- Shirasago Y, Shimizu Y, Tanida I, Suzuki T, Suzuki R, Sugiyama K, Wakita T, Hanada K, Yagi K, Kondoh M, and *Fukasawa M (2016) Occludin-knockout human hepatic Huh7.5.1-8-derived cells are completely resistant to hepatitis C virus infection, Biol Pharm Bull, 39, 839–848. doi: 10.1248/bpb.b15-01023
2015年
- Sawada K, Sato T, Hamajima H, Jayakody NL, Hirata M, Yamashiro M, Tajima M, Mitsutake S, Nagao K, Tsuge K, Abe F, Hanada K, and *Kitagaki H (2015) Glucosylceramide contained in mold-cultured cereal confers membrane and flavor modification and stress tolerance to yeast during co-culture fermentation, Appl Environ Microbiol, 81, 3688-3698. doi:10.1128/AEM.00454-15
- *Fukasawa M, Nagase S, Shirasago Y, Iida M, Yamashita M, Endo K, Yagi K, Suzuki T, Wakita T, Hanada K, Kuniyasu H, and Kondoh M (2015) Monoclonal antibodies against extracellular domains of claudin-1 block hepatitis C virus infection in a mouse model, J Virol, 89, 4866-4879. doi: 10.1128/JVI.03676-14
- *Kang H, Xu M, Rodríguez VP, Mefed K, Hanada K, Ahn K, Gangakhedkar SJ, Pakzad SR, Prawahju EI, Lee N, Phumiamorn S, Nemec M, Meng S, Knezevic I (2015) Review of the current use and evaluation of cell substrates for producing biologicals in selected countries, Biologicals, 43, 153-157. doi: 10.1016/j.biologicals.2015.01.004
- Zhao Y, Ishigami M, Nagao K, Hanada K, Kono N, Arai H, Matsuo M, Kioka N, *Ueda K (2015) ABCB4 exports phosphatidylcholine in a sphingomyelin-dependent manner, J Lipid Res, 56, 644-652. doi: 10.1194/jlr.M056622
- Saito K, Suzuki T, Aizaki H, Hanada K, Wakita T, Nishijima M, *Fukasawa M (2015) Targeting cellular squalene synthase, an enzyme essential for cholesterol biosynthesis, is a potential antiviral strategy against hepatitis C virus. J Virol, 89, 2220-2232. doi:10.1128/JVI.03385-14
- *Yamaji T, and Hanada, K (2015) Sphingolipid metabolism and interorganellar transport: localization of sphingolipid enzymes and lipid transfer proteins, Traffic, 16, 101-122. doi: 10.1111/tra.12239
- Shirasago Y, Sekizuka T, Saito K, Suzuki T, Wakita W, Hanada K, Kuroda M, Abe R, *Fukasawa M (2015) Isolation and characterization of a Huh.7.5.1-derived cell clone highly permissive to hepatitis C virus. Jpn J Infect Dis, 68, 81-88. doi: 10.7883/yoken.JJID.2014.231
- Tanida I, Shirasago Y, Suzuki R, Abe R, Wakita T, Hanada K, and *Fukasawa M (2015) Inhibitory effects of caffeic acid, a coffee-related organic acid, on the propagation of hepatitis C virus, Jpn J Infect Dis, 68, 268-275. doi: 10.7883/yoken.JJID.2014.309
2014年
- Osada N, Kohara A, Yamaji T, Hirayama N, Kasai F, Sekizuka T, Kuroda M, *Hanada K (2014) The genome landscape of the African green monkey kidney-derived Vero cell line, DNA Res, 21, 673-683. doi: 10.1093/dnares/dsu029 (N.O. and A.K. equally contributed to this paper, and thus are co-first authors) (Open access: http://dnaresearch.oxfordjournals.org/content/21/6/673)
- Khan I, Katikaneni DS, Han Q, Sanchez-Felipe L, Hanada K, Ambrose RL, Mackenzie JM, and *Konan KV (2014) Modulation of hepatitis C virus genome replication by glycosphingolipids and four-phosphate adaptor protein 2, J Virol, 88, 12276-12295. doi:10.1128/JVI.00970-14
- *Hanada K, Voelker D (co-guest editors) (2014) Interorganelle trafficking of lipids: preface for the thematic review series, Traffic, 15, 889-894. doi:10.1111_tra.12193 (Open access:: http://onlinelibrary.wiley.com/doi/10.1111/tra.12193/epdf)(本論文が掲載された号の表紙に花田の作成した図が採用された)
- *Ogawa M, *Fukasawa M, Satoh M, Hanada K, Saijo M, Uchiyama T, and Ando S (2014) The intracellular pathogen Orientia tsutsugamushi responsible for scrub typhus induces lipid droplet formation in mouse fibroblasts, Microbe Infect., 16, 962-966. doi: 10.1016/j.micinf.2014.09.004
- Sano O, Ito S, Kato R, Shimizu Y, Kobayashi A, Kimura Y, Kioka N, Hanada K, Ueda K, and *Matsuo M: ABCA1, ABCG1, and ABCG4 are distributed to distinct membrane meso-domains and disturb detergent-resistant domains on the plasma membrane, PLoS One, 9, e109886. doi: 10.1371/journal.pone.0109886
- Hasegawa Y, *Hayashi H, Naoi S, *Kondou H, Bessho K, Igarashi K, Hanada K, Nakao K, Kimura T, Konishi A, Nagasaka H, Miyoshi Y, Ozono K, Kusuhara H (2014) Intractable itch relieved by 4-phenylbutyrate therapy in patients with progressive familial intrahepatic cholestasis type 1, Orphanet J Rare Dis, 9, 89. doi:10.1186/1750-1172-9-89
- *Maehama T, Kawahara K, Nishio M, Suzuki A, Hanada K (2014) Nucleolar stress induces ubiquitination-independent proteasomal degradation of PICT1, J Biol Chem, 289, 20802-20812. doi: 10.1074/jbc.M114.571893
- Kumagai K, Kawano-Kawada M, *Hanada K (2014) Phosphoregulation of the ceramide transport protein CERT at serine 315 in the interaction with VAMP-associated protein (VAP) for inter-organelle trafficking of ceramide in mammalian cells, J Biol Chem, 289, 10748-10760. Open access:https://doi.org/10748-10760. 10.1074/jbc.M113.528380
- *Yamaji T, *Hanada K (2014) Establishment of HeLa cell mutants deficient in sphingolipid-related genes by using TALENs, PLoS ONE, 9, e88124. 10.1371/journal.pone.0088124. (Open access: http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0088124)
- Kajiwara K, Ikeda A, Aguilera-Romero A, Castillon GA, Kagiwada S, Hanada K, Riezman H, Muniz M, *Funato K (2014) Osh proteins regulate COPII-mediated vesicular transport of ceramide from the endoplasmic reticulum in budding yeast, J Cell Sci, 127, 376-387. 10.1242/jcs.132001.
- *Hanada K (2014) Co-evolution of sphingomyelin and the ceramide transport protein CERT, Biochim Biophys Acta, 1841, 704-719. doi: 10.1016/j.bbalip.2013.06.006 [Corrigendum (2014) 1841, 1561-1562; doi: 10.1016/j.bbalip.2014.08.002].
2013年
- *Maehama T, Fukasawa M, Date T, Wakita T, Hanada K (2013) A class II phosphoinositide 3-kinase plays an indispensable role in hepatitis C virus replication, Biochem Biophys Res Commun, 440, 150-156. doi: 10.1016/j.bbrc.2013.09.048.
- *Kukimoto I, Maehama T, Sekizuka T, Ogasawara Y, Kondo K, Kusumoto-Matsuo R, Mori S, Ishii Y, Takeuchi T, Yamaji T, Takeuchi F, Hanada K, Kuroda M (2013) Genetic variation of human papillomavirus type 16 in individual clinical specimens revealed by deep sequencing, PLoS One, 8, e80583. doi: 10.1371/journal.pone.0080583.
- *Hagiwara K, Hara H, Hanada K (2013) Species-barrier phenomenon in prion transmissibility from a viewpoint of protein science, J Biochem, 153, 139-145. doi: 10.1093/jb/mvs148.
- Pratt S, Wansadhipathi-Kannangara NK, Bruce CR, Mina JG, Shams-Eldin H, Casas J, Hanada K, Schwarz RT, Sonda S, *Denny PW, Sphingolipid synthesis and scavenging in the intracellular apicomplexan parasite, Toxoplasma gondii, Mol Biochem Parasitol, 187, 43-51. doi: 10.1016/j.molbiopara.2012.11.007.
2012年
- Abe M, Makino A, Hullin-Matsuda F, Kamijo K, Ohno-Iwashita Y, Hanada K, Mizuno H, Miyawaki A, *Kobayashi T (2012) A role for sphingomyelin-rich lipid domains in the accumulation of phosphatidylinositol-4,5-bisphosphate to the cleavage furrow during cytokinesis, Mol Cell Biol, 32, 1396-1407. doi: 10.1128/MCB.06113-11.
- Sugiki T, Takeuchi K, Yamaji T, Takano T, Tokunaga Y, Kumagai K, Hanada K, *Takahashi H, *Shimada I (2012) Structural basis for the Golgi association by the pleckstrin homology domain of the ceramide trafficking protein (CERT), J Biol Chem, 287, 33706-33718. doi: 10.1074/jbc.M112.367730.
- Kumagai K, Nishijima M, *Hanada K (2012) Reconstitution assay system for ceramide transport with semi-intact cells, Methods Cell Biol, 108, 117-129. doi: 10.1016/B978-0-12-386487-1.00006-7.
- Hullin-Matsuda F, Tomishige N, Sakai S, Ishitsuka R, Ishii K, Makino A, Greimel P, Abe M, Laviad EL, Lagarde M, Vidal H, Saito T, Osada H, Hanada K, Futerman AH, *Kobayashi T (2012) Limonoid compounds inhibit sphingomyelin biosynthesis by preventing CERT protein-dependent extraction of ceramides from the endoplasmic reticulum, J Biol Chem, 287, 24397-24411. doi: 10.1074/jbc.M112.356733.
- Hara H, Okemoto-Nakamura Y, Shinkai-Ouchi F, Hanada K, Yamakawa Y, *Hagiwara K (2012) Mouse prion protein (PrP) segment 100 to 104 regulates conversion of PrP(C) to PrP(Sc) in prion-infected neuroblastoma cells, J Virol, 86, 5626-5636. doi: 10.1128/jvi.06606-11.
2011年
- Tuuf J, Kjellberg MA, Molotkovsky JG, Hanada K, *Mattjus P (2011) The intermembrane ceramide transport catalyzed by CERT is sensitive to the lipid environment, Biochim Biophys Acta, 1808, 229-235. doi: 10.1016/j.bbamem.2010.09.011.
- Elwell CA, Jiang S, Kim JH, Lee A, Wittmann T, Hanada K, Melancon P, *Engel JN (2011) Chlamydia trachomatis co-opts GBF1 and CERT to acquire host sphingomyelin for distinct roles during intracellular development, PLoS Pathog, 7, e1002198. doi: 10.1371/journal.ppat.1002198.
2010年
- *Yamaji T, Nishikawa K, Hanada K (2010) Transmembrane BAX inhibitor motif containing (TMBIM) family proteins perturbs a trans-Golgi network enzyme, Gb3 synthase, and reduces Gb3 biosynthesis, J Biol Chem, 285, 35505-35518. doi: 10.1074/jbc.M110.154229.
- Tanaka M, Hara H, Nishina H, Hanada K, Hagiwara K, *Maehama T (2010) An improved method for cell-to-cell transmission of infectious prion, Biochem Biophys Res Commun, 397, 505-508. doi: 10.1016/j.bbrc.2010.05.143.
- Sugiki T, Takahashi H, Nagasu M, Hanada K, *Shimada I (2010) Real-time assay method of lipid extraction activity, Anal Biochem, 399, 162-167. doi: 10.1016/j.ab.2009.12.031.
- Shinkai-Ouchi F, Yamakawa Y, Hara H, Tobiume M, Nishijima M, Hanada K, *Hagiwara K (2010) Identification and structural analysis of C-terminally truncated collapsin response mediator protein-2 in a murine model of prion diseases, Proteome Sci, 8, 53. doi: 10.1186/1477-5956-8-53.
- *Separovic D, Kelekar A, Nayak AK, Tarca AL, Hanada K, Pierce JS, Bielawski J (2010) Increased ceramide accumulation correlates with downregulation of the autophagy protein ATG-7 in MCF-7 cells sensitized to photodamage, Arch Biochem Biophys, 494, 101-105. doi: 10.1016/j.abb.2009.11.023.
- Rivier AS, Castillon GA, Michon L, Fukasawa M, Romanova-Michaelides M, Jaensch N, Hanada K, *Watanabe R (2010) Exit of GPI-anchored proteins from the ER differs in yeast and mammalian cells, Traffic, 11, 1017-1033. doi: 10.1111/j.1600-0854.2010.01081.x.
- *Nakamura H, Wakita S, Suganami A, Tamura Y, Hanada K, Murayama T (2010) Modulation of the activity of cytosolic phospholipase A2alpha (cPLA2alpha) by cellular sphingolipids and inhibition of cPLA2alpha by sphingomyelin, J Lipid Res, 51, 720-728. doi: 10.1194/jlr.M002428.
- Kudo N, Kumagai K, Matsubara R, Kobayashi S, Hanada K, Wakatsuki S, *Kato R (2010) Crystal structures of the CERT START domain with inhibitors provide insights into the mechanism of ceramide transfer, J Mol Biol, 396, 245-251. doi: 10.1016/j.jmb.2009.12.029.
- *Hanada K (2010) Intracellular trafficking of ceramide by ceramide transfer protein, Proc Jpn Acad Ser B Phys Biol Sci, 86, 426-437. doi: 10.2183/pjab.86.426. (Open access: https://www.jstage.jst.go.jp/article/pjab/86/4/86_4_426/_article)
2009年
- Tomishige N, Kumagai K, Kusuda J, Nishijima M, *Hanada K (2009) Casein kinase I{gamma}2 down-regulates trafficking of ceramide in the synthesis of sphingomyelin, Mol Biol Cell, 20, 348-357. doi: 10.1091/mbc.E08-07-0669. (Open access: http://www.molbiolcell.org/content/20/1/348.long)
- *Tanida I, Fukasawa M, Ueno T, Kominami E, Wakita T, Hanada K (2009) Knockdown of autophagy-related gene decreases the production of infectious hepatitis C virus particles, Autophagy, 5, 937-945.
- Nitahara-Kasahara Y, *Fukasawa M, Shinkai-Ouchi F, Sato S, Suzuki T, Murakami K, Wakita T, Hanada K, Miyamura T, Nishijima M (2009) Cellular vimentin content regulates the protein level of hepatitis C virus core protein and the hepatitis C virus production in cultured cells, Virology, 383, 319-327. doi: 10.1016/j.virol.2008.10.009.
- Momin AA, Park H, Allegood JC, Leipelt M, Kelly SL, *Merrill AH, Jr., Hanada K (2009) Characterization of mutant serine palmitoyltransferase 1 in LY-B cells, Lipids, 44, 725-732. doi: 10.1007/s11745-009-3316-4.
- *Hanada K, Kumagai K, Tomishige N, Yamaji T (2009) CERT-mediated trafficking of ceramide, Biochim Biophys Acta, 1791, 684-691. doi: 10.1016/j.bbalip.2009.01.006.(本論文が掲載された号の表紙に我々の研究結果が採用された)
2008年
- Yamaji T, Kumagai K, Tomishige N, *Hanada K (2008) Two sphingolipid transfer proteins, CERT and FAPP2: their roles in sphingolipid metabolism, IUBMB Life, 60, 511-518. doi: 10.1002/iub.83. (Open access: http://onlinelibrary.wiley.com/doi/10.1002/iub.83/pdf)
- Tsuda K, Furuta N, Inaba H, Kawai S, Hanada K, *Yoshimori T, Amano A (2008) Functional analysis of alpha5beta1 integrin and lipid rafts in invasion of epithelial cells by Porphyromonas gingivalis using fluorescent beads coated with bacterial membrane vesicles, Cell Struct Funct, 33, 123-132.
- *Tanida I, Yamaji T, Ueno T, Ishiura S, Kominami E, Hanada K (2008) Consideration about negative controls for LC3 and expression vectors for four colored fluorescent protein-LC3 negative controls, Autophagy, 4, 131-134.
- *Separovic D, Semaan L, Tarca AL, Awad Maitah MY, Hanada K, Bielawski J, Villani M, Luberto C (2008) Suppression of sphingomyelin synthase 1 by small interference RNA is associated with enhanced ceramide production and apoptosis after photodamage, Exp Cell Res, 314, 1860-1868. doi: 10.1016/j.yexcr.2008.02.008.
- Saito S, Matsui H, Kawano M, Kumagai K, Tomishige N, Hanada K, Echigo S, *Tamura S, *Kobayashi T (2008) Protein phosphatase 2Cepsilon is an endoplasmic reticulum integral membrane protein that dephosphorylates the ceramide transport protein CERT to enhance its association with organelle membranes, J Biol Chem, 283, 6584-6593. doi: 10.1074/jbc.M707691200.
- Okemoto-Nakamura Y, Yamakawa Y, Hanada K, Tanaka K, Miura M, Tanida I, Nishijima M, *Hagiwara K (2008) Synthetic fibril peptide promotes clearance of scrapie prion protein by lysosomal degradation, Microbiol Immunol, 52, 357-365. doi: 10.1111/j.1348-0421.2008.00046.x.
- Okemoto K, Hanada K, Nishijima M, *Kawasaki K (2008) The preparation of a lipidic endotoxin affects its biological activities, Biol Pharm Bull, 31, 1952-1954.
- *Maehama T, Tanaka M, Nishina H, Murakami M, Kanaho Y, Hanada K (2008) RalA functions as an indispensable signal mediator for the nutrient-sensing system, J Biol Chem, 283, 35053-35059. doi: 10.1074/jbc.M805822200.
- Kudo N, Kumagai K, Tomishige N, Yamaji T, *Wakatsuki S, Nishijima M, *Hanada K, Kato R (2008) Structural basis for specific lipid recognition by CERT responsible for nonvesicular trafficking of ceramide, Proc Natl Acad Sci U S A, 105, 488-493. doi: 10.1073/pnas.0709191105. (Open access: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2206563/)
- *Haruna K, Suga Y, Muramatsu S, Taneda K, Mizuno Y, Ikeda S, Ueno T, Kominami E, Tanida I, Tanida I, Hanada K (2008) Differentiation-specific expression and localization of an autophagosomal marker protein (LC3) in human epidermal keratinocytes, J Dermatol Sci, 52, 213-215. doi: 10.1016/j.jdermsci.2008.07.005.
- Haberkant P, Schmitt O, Contreras FX, Thiele C, Hanada K, Sprong H, Reinhard C, *Wieland FT, *Brugger B (2008) Protein-sphingolipid interactions within cellular membranes, J Lipid Res, 49, 251-262. doi: 10.1194/jlr.D700023-JLR200.
- Giussani P, Colleoni T, Brioschi L, Bassi R, Hanada K, Tettamanti G, Riboni L, *Viani P (2008) Ceramide traffic in C6 glioma cells: evidence for CERT-dependent and independent transport from ER to the Golgi apparatus, Biochim Biophys Acta, 1781, 40-51. doi: 10.1016/j.bbalip.2007.11.002.
- Charruyer A, Bell SM, Kawano M, Douangpanya S, Yen TY, Macher BA, Kumagai K, Hanada K, Holleran WM, *Uchida Y (2008) Decreased ceramide transport protein (CERT) function alters sphingomyelin production following UVB irradiation, J Biol Chem, 283, 16682-16692. doi: 10.1074/jbc.M800799200.
- Aizaki H, Morikawa K, Fukasawa M, Hara H, Inoue Y, Tani H, Saito K, Nishijima M, Hanada K, Matsuura Y, Lai MM, Miyamura T, Wakita T, *Suzuki T (2008) Critical role of virion-associated cholesterol and sphingolipid in hepatitis C virus infection, J Virol, 82, 5715-5724. doi: 10.1128/JVI.02530-07.
2007年
- Shi L, Bielawski J, Mu J, Dong H, Teng C, Zhang J, Yang X, Tomishige N, Hanada K, Hannun YA, *Zuo J (2007) Involvement of sphingoid bases in mediating reactive oxygen intermediate production and programmed cell death in Arabidopsis, Cell Res, 17, 1030-1040. doi: 10.1038/cr.2007.100.
- *Separovic D, Hanada K, Maitah MY, Nagy B, Hang I, Tainsky MA, Kraniak JM, Bielawski J (2007) Sphingomyelin synthase 1 suppresses ceramide production and apoptosis post-photodamage, Biochem Biophys Res Commun, 358, 196-202. doi: 10.1016/j.bbrc.2007.04.095.
- Sano O, Kobayashi A, Nagao K, Kumagai K, Kioka N, Hanada K, *Ueda K, Matsuo M (2007) Sphingomyelin-dependence of cholesterol efflux mediated by ABCG1, J Lipid Res, 48, 2377-2384. doi: 10.1194/jlr.M700139-JLR200.
- Nagao K, Takahashi K, Hanada K, Kioka N, Matsuo M, *Ueda K (2007) Enhanced apoA-I-dependent cholesterol efflux by ABCA1 from sphingomyelin-deficient Chinese hamster ovary cells, J Biol Chem, 282, 14868-14874. doi: 10.1074/jbc.M611230200.
- Kumagai K, Kawano M, Shinkai-Ouchi F, Nishijima M, *Hanada K (2007) Interorganelle trafficking of ceramide is regulated by phosphorylation-dependent cooperativity between the PH and START domains of CERT, J Biol Chem, 282, 17758-17766. doi: 10.1074/jbc.M702291200. (Open access: http://www.jbc.org/content/282/24/17758.long)
- *Hanada K, Kumagai K, Tomishige N, Kawano M (2007) CERT and intracellular trafficking of ceramide, Biochim Biophys Acta, 1771, 644-653. doi: 10.1016/j.bbalip.2007.01.009.
2006年
- Valeva A, Hellmann N, Walev I, Strand D, Plate M, Boukhallouk F, Brack A, Hanada K, Decker H, *Bhakdi S (2006) Evidence that clustered phosphocholine head groups serve as sites for binding and assembly of an oligomeric protein pore, J Biol Chem, 281, 26014-26021. doi: 10.1074/jbc.M601960200.
- *Separovic D, Wang S, Awad Maitah MY, Hanada K, Kessel D (2006) Ceramide response post-photodamage is absent after treatment with HA14-1, Biochem Biophys Res Commun, 345, 803-808. doi: 10.1016/j.bbrc.2006.04.131.
- Okemoto K, Kawasaki K, Hanada K, Miura M, *Nishijima M (2006) A potent adjuvant monophosphoryl lipid A triggers various immune responses, but not secretion of IL-1beta or activation of caspase-1, J Immunol, 176, 1203-1208.
- Kawano M, Kumagai K, Nishijima M, *Hanada K (2006) Efficient trafficking of ceramide from the endoplasmic reticulum to the Golgi apparatus requires a VAMP-associated protein-interacting FFAT motif of CERT, J Biol Chem, 281, 30279-30288. doi: 10.1074/jbc.M605032200. (Open access: http://www.jbc.org/content/281/40/30279.long)
- *Hanada K (2006) Discovery of the molecular machinery CERT for endoplasmic reticulum-to-Golgi trafficking of ceramide, Mol Cell Biochem, 286, 23-31. doi: 10.1007/s11010-005-9044-z.
- Grimmer S, Spilsberg B, *Hanada K, Sandvig K (2006) Depletion of sphingolipids facilitates endosome to Golgi transport of ricin, Traffic, 7, 1243-1253. 10.1111/j.1600-0854.2006.00456.x.
- *Fukasawa M, Tanaka Y, Sato S, Ono Y, Nitahara-Kasahara Y, Suzuki T, Miyamura T, Hanada K, Nishijima M (2006) Enhancement of de novo fatty acid biosynthesis in hepatic cell line Huh7 expressing hepatitis C virus core protein, Biol Pharm Bull, 29, 1958-1961.
- Cheng ZJ, Singh RD, Sharma DK, Holicky EL, Hanada K, Marks DL, *Pagano RE (2006) Distinct mechanisms of clathrin-independent endocytosis have unique sphingolipid requirements, Mol Biol Cell, 17, 3197-3210. doi: 10.1091/mbc.E05-12-1101.
2005年
- Tse SM, Mason D, Botelho RJ, Chiu B, Reyland M, Hanada K, Inman RD, *Grinstein S (2005) Accumulation of diacylglycerol in the Chlamydia inclusion vacuole: possible role in the inhibition of host cell apoptosis, J Biol Chem, 280, 25210-25215. doi: 10.1074/jbc.M501980200.
- Spilsberg B, Hanada K, *Sandvig K (2005) Diphtheria toxin translocation across cellular membranes is regulated by sphingolipids, Biochem Biophys Res Commun, 329, 465-473. doi: 10.1016/j.bbrc.2005.02.005.
- Kumagai K, Yasuda S, Okemoto K, Nishijima M, Kobayashi S, *Hanada K (2005) CERT mediates intermembrane transfer of various molecular species of ceramides, J Biol Chem, 280, 6488-6495. 10.1074/jbc.M409290200. (Open access: http://www.jbc.org/content/281/40/30279.long)
- Harikumar KG, Puri V, Singh RD, Hanada K, Pagano RE, *Miller LJ (2005) Differential effects of modification of membrane cholesterol and sphingolipids on the conformation, function, and trafficking of the G protein-coupled cholecystokinin receptor, J Biol Chem, 280, 2176-2185. 10.1074/jbc.M410385200.
- *Hanada K (2005) Sphingolipids in infectious diseases, Jpn J Infect Dis, 58, 131-148. (Open access: https://www0.niid.go.jp/JJID/58/131.pdf)
- Dolgachev V, Oberley LW, Huang TT, Kraniak JM, Tainsky MA, Hanada K, *Separovic D (2005) A role for manganese superoxide dismutase in apoptosis after photosensitization, Biochem Biophys Res Commun, 332, 411-417. doi: 10.1016/j.bbrc.2005.04.141.
2004年
- Sawamura N, Ko M, Yu W, Zou K, Hanada K, Suzuki T, Gong JS, Yanagisawa K, *Michikawa M (2004) Modulation of amyloid precursor protein cleavage by cellular sphingolipids, J Biol Chem, 279, 11984-11991. doi: 10.1074/jbc.M309832200.
- Miura Y, Gotoh E, Nara F, Nishijima M, *Hanada K (2004) Hydrolysis of sphingosylphosphocholine by neutral sphingomyelinases, FEBS Lett, 557, 288-292 doi:10.1016/S0014-5793(03)01523-0 (Open access: http://www.sciencedirect.com/science/article/pii/S0014579303015230) [Correction, (2004) 565, 207; doi:10.1016/j.febslet.2004.04.001; Open access: http://www.sciencedirect.com/science/article/pii/S0014579304003965]
- Dolgachev V, Farooqui MS, Kulaeva OI, Tainsky MA, Nagy B, Hanada K, *Separovic D (2004) De novo ceramide accumulation due to inhibition of its conversion to complex sphingolipids in apoptotic photosensitized cells, J Biol Chem, 279, 23238-23249. doi: 10.1074/jbc.M311974200.
- Carracedo A, Geelen MJ, Diez M, Hanada K, Guzman M, *Velasco G (2004) Ceramide sensitizes astrocytes to oxidative stress: protective role of cannabinoids, Biochem J, 380, 435-440. doi: 10.1042/bj20031714.
2003年
- Yasuda S, Nishijima M, *Hanada K (2003) Localization, topology, and function of the LCB1 subunit of serine palmitoyltransferase in mammalian cells, J Biol Chem, 278, 4176-4183. doi: 10.1074/jbc.M209602200. (Open access: http://www.jbc.org/content/278/6/4176.long)
- Nakamura Y, Matsubara R, Kitagawa H, *Kobayashi S, Kumagai K, Yasuda S, *Hanada K (2003) Stereoselective synthesis and structure-activity relationship of novel ceramide trafficking inhibitors. (1R,3R)-N-(3-hydroxy-1-hydroxymethyl-3-phenylpropyl)dodecanamide and its analogues, J Med Chem, 46, 3688-3695. doi: 10.1021/jm0300779.
- Nakamura M, Mori Y, Okuyama K, Tanikawa K, Yasuda S, Hanada K, *Kobayashi S (2003) Chemistry and biology of khafrefungin. Large-scale synthesis, design, and structure-activity relationship of khafrefungin, an antifungal agent, Org Biomol Chem, 1, 3362-3376.
- *Hanada K, Nishijima M (2003) Purification of mammalian serine palmitoyltransferase, a hetero-subunit enzyme for sphingolipid biosynthesis, by affinity-peptide chromatography, Methods Mol Biol, 228, 163-174. doi: 10.1385/1-59259-400-X:163.
- *Hanada K, Kumagai K, Yasuda S, Miura Y, Kawano M, Fukasawa M, Nishijima M (2003) Molecular machinery for non-vesicular trafficking of ceramide, Nature, 426, 803-809. doi: 10.1038/nature02188.
- *Hanada K (2003) Serine palmitoyltransferase, a key enzyme of sphingolipid metabolism, Biochim Biophys Acta, 1632, 16-30. doi:10.1016/S1388-1981(03)00059-3.
- Dolgachev V, Nagy B, Taffe B, Hanada K, *Separovic D (2003) Reactive oxygen species generation is independent of de novo sphingolipids in apoptotic photosensitized cells, Exp Cell Res, 288, 425-436.
2002年
- Wispriyono B, Schmelz E, Pelayo H, Hanada K, *Separovic D (2002) A role for the de novo sphingolipids in apoptosis of photosensitized cells, Exp Cell Res, 279, 153-165.
- *Lafont F, Tran Van Nhieu G, Hanada K, Sansonetti P, van der Goot FG (2002) Initial steps of Shigella infection depend on the cholesterol/sphingolipid raft-mediated CD44-IpaB interaction, EMBO J, 21, 4449-4457.
- *Hanada K, Palacpac NM, Magistrado PA, Kurokawa K, Rai G, Sakata D, Hara T, Horii T, Nishijima M, *Mitamura T (2002) Plasmodium falciparum phospholipase C hydrolyzing sphingomyelin and lysocholinephospholipids is a possible target for malaria chemotherapy, J Exp Med, 195, 23-34. (Open access: http://jem.rupress.org/content/195/1/23.long)
- Bejaoui K, Uchida Y, Yasuda S, Ho M, Nishijima M, Brown RH, Jr., Holleran WM, *Hanada K (2002) Hereditary sensory neuropathy type 1 mutations confer dominant negative effects on serine palmitoyltransferase, critical for sphingolipid synthesis, J Clin Invest, 110, 1301-1308. 10.1172/JCI16450. (Open access: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC151618/)
2001年
- Yasuda S, Kitagawa H, Ueno M, Ishitani H, Fukasawa M, Nishijima M, Kobayashi S, *Hanada K (2001) A novel inhibitor of ceramide trafficking from the endoplasmic reticulum to the site of sphingomyelin synthesis, J Biol Chem, 276, 43994-44002. doi: 10.1074/jbc.M104884200 (Open access: http://www.jbc.org/content/276/47/43994.long) [Errantum, (2013) 288, 24162; doi: 10.1074/jbc.A113.104884; Open access: http://www.jbc.org/content/288/33/24162.short]
- Miura Y, Hanada K, *Jones TL (2001) G(s) signaling is intact after disruption of lipid rafts, Biochemistry, 40, 15418-15423.
- *Kobayashi S, Mori K, Wakabayashi T, Yasuda S, Hanada K (2001) Convergent total synthesis of khafrefungin and its inhibitory activity of fungal sphingolipid syntheses, J Org Chem, 66, 5580-5584.
- Chatterjee S, Smith ER, Hanada K, Stevens VL, *Mayor S (2001) GPI anchoring leads to sphingolipid-dependent retention of endocytosed proteins in the recycling endosomal compartment, EMBO J, 20, 1583-1592. doi: 10.1093/emboj/20.7.1583.
- Ueno, M, Kitagawa H, , Ishitani H, Yasuda S, Hanada K, *Kobayashi S (2001) Catalytic enantioselective synthesis of a novel inhibitor of ceramide trafficking, (1R,3R)-N-(3-hydroxy-1-hydroxymethyl-3-phenylpropyl)dodecanamide (HPA-12), Tetrahedron Lett. 42, 7863-7865.
2000年
- van Ooij C, Kalman L, van I, Nishijima M, Hanada K, Mostov K, *Engel JN (2000) Host cell-derived sphingolipids are required for the intracellular growth of Chlamydia trachomatis, Cell Microbiol, 2, 627-637.
- *Mitamura T, Hanada K, Ko-Mitamura EP, Nishijima M, Horii T (2000) Serum factors governing intraerythrocytic development and cell cycle progression of Plasmodium falciparum, Parasitol Int, 49, 219-229.
- *Hanada K, Nishijima M, Fujita T, Kobayashi S (2000) Specificity of inhibitors of serine palmitoyltransferase (SPT), a key enzyme in sphingolipid biosynthesis, in intact cells. A novel evaluation system using an SPT-defective mammalian cell mutant, Biochem Pharmacol, 59, 1211-1216.
- *Hanada K, Nishijima M (2000) Selection of mammalian cell mutants in sphingolipid biosynthesis, Methods Enzymol, 312, 304-317.
- *Hanada K, Mitamura T, Fukasawa M, Magistrado PA, Horii T, Nishijima M (2000) Neutral sphingomyelinase activity dependent on Mg2+ and anionic phospholipids in the intraerythrocytic malaria parasite Plasmodium falciparum, Biochem J, 346, 671-677. (Open access: http://www.biochemj.org/bj/346/0671/bj3460671.htm)
- *Hanada K, Hara T, Nishijima M (2000) D-Serine inhibits serine palmitoyltransferase, the enzyme catalyzing the initial step of sphingolipid biosynthesis, FEBS Lett, 474, 63-65. (Open access: http://www.sciencedirect.com/science/article/pii/S0014579300015799)
- *Hanada K, Hara T, Nishijima M (2000) Purification of the serine palmitoyltransferase complex responsible for sphingoid base synthesis by using affinity peptide chromatography techniques, J Biol Chem, 275, 8409-8415. (Open access: http://www.jbc.org/content/275/12/8409.long)
- Funakoshi T, Yasuda S, Fukasawa M, Nishijima M, *Hanada K (2000) Reconstitution of ATP- and cytosol-dependent transport of de novo synthesized ceramide to the site of sphingomyelin synthesis in semi-intact cells, J Biol Chem, 275, 29938-29945. 10.1074/jbc.M004470200. (Open access: http://www.jbc.org/content/275/39/29938.long)
- Fukasawa M, Nishijima M, Itabe H, Takano T, *Hanada K (2000) Reduction of sphingomyelin level without accumulation of ceramide in Chinese hamster ovary cells affects detergent-resistant membrane domains and enhances cellular cholesterol efflux to methyl-beta -cyclodextrin, J Biol Chem, 275, 34028-34034. doi: 10.1074/jbc.M005151200. (Open access: http://www.jbc.org/content/275/44/34028.long)
1999年以前
- Fukasawa M, Nishijima M, *Hanada K (1999) Genetic evidence for ATP-dependent endoplasmic reticulum-to-Golgi apparatus trafficking of ceramide for sphingomyelin synthesis in Chinese hamster ovary cells, J Cell Biol, 144, 673-685. (Open access: http://jcb.rupress.org/content/144/4/673.long)
- Suzuki T, Suzuki Y, Hanada K, Hashimoto A, Redpath JL, Stanbridge EJ, Nishijima M, *Kitagawa T (1998) Reduction of caveolin-1 expression in tumorigenic human cell hybrids, J Biochem, 124, 383-388.
- *Kobayashi S, Furuta T, Hayashi T, Nishijima M, Hanada K (1998) Catalytic asymmetric syntheses of antifungal sphingofungins and their biological activity as potent inhibitors of serine palmitoyltransferase (SPT), J Am Chem Soc, 200, 908-919.
- *Hanada K, Hara T, Fukasawa M, Yamaji A, Umeda M, Nishijima M (1998) Mammalian cell mutants resistant to a sphingomyelin-directed cytolysin. Genetic and biochemical evidence for complex formation of the LCB1 protein with the LCB2 protein for serine palmitoyltransferase, J Biol Chem, 273, 33787-33794. (Open access: http://www.jbc.org/content/273/50/33787.long)
- Yamamoto H, Hanada K, *Nishijima M (1997) Involvement of diacylglycerol production in activation of nuclear factor kappaB by a CD14-mediated lipopolysaccharide stimulus, Biochem J, 325 ( Pt 1), 223-228.
- Yamamoto H, Hanada K, Kawasaki K, *Nishijima M (1997) Inhibitory effect on curcumin on mammalian phospholipase D activity, FEBS Lett, 417, 196-198.
- *Hanada K, Hara T, Nishijima M, Kuge O, Dickson RC, Nagiec MM (1997) A mammalian homolog of the yeast LCB1 encodes a component of serine palmitoyltransferase, the enzyme catalyzing the first step in sphingolipid synthesis, J Biol Chem, 272, 32108-32114. (Open access: http://www.jbc.org/content/272/51/32108.long)
- Fukasawa M, Sekine F, Miura M, Nishijima M, *Hanada K (1997) Involvement of heparan sulfate proteoglycans in the binding step for phagocytosis of latex beads by Chinese hamster ovary cells, Exp Cell Res, 230, 154-162. doi: 10.1006/excr.1996.3403.
- Hanada K, *Pagano RE (1995) A Chinese hamster ovary cell mutant defective in the non-endocytic uptake of fluorescent analogs of phosphatidylserine: isolation using a cytosol acidification protocol, J. Cell Biol., 128, 793-804.
- *Hanada K, Nishijima M, Akamatsu Y, Pagano RE (1995) Both sphingolipids and cholesterol participate in the detergent insolubility of alkaline phosphatase, a glycosylphosphatidylinositol-anchored protein, in mammalian membranes, J Biol Chem, 270, 6254-6260. (Open access: http://www.jbc.org/content/270/11/6254.long)
- *Hanada K, Izawa K, Nishijima M, Akamatsu Y (1993) Sphingolipid deficiency induces hypersensitivity of CD14, a glycosyl phosphatidylinositol-anchored protein, to phosphatidylinositol-specific phospholipase C, J Biol Chem, 268, 13820-13823. (Open access: http://www.jbc.org/content/268/19/13820.long)
- Hanada K, Yoshida T, Yamato I, *Anraku Y (1992) Sodium ion and proline binding sites in the Na+/proline symport carrier of Escherichia coli, Biochim Biophys Acta, 1105, 61-66.
- *Hanada K, Nishijima M, Kiso M, Hasegawa A, Fujita S, Ogawa T, Akamatsu Y (1992) Sphingolipids are essential for the growth of Chinese hamster ovary cells. Restoration of the growth of a mutant defective in sphingoid base biosynthesis by exogenous sphingolipids, J Biol Chem, 267, 23527-23533. (Open access: http://www.jbc.org/content/267/33/23527.long)
- *Hanada K, Horii M, Akamatsu Y (1991) Functional reconstitution of sphingomyelin synthase in Chinese hamster ovary cell membranes, Biochim Biophys Acta, 1086, 151-156.
- *Hanada K, Nishijima M, Akamatsu Y (1990) A temperature-sensitive mammalian cell mutant with thermolabile serine palmitoyltransferase for the sphingolipid biosynthesis, J Biol Chem, 265, 22137-22142. (Open access: http://www.jbc.org/content/265/36/22137.long)
- Komeiji Y, Hanada K, Yamato I, *Anraku Y (1989) Orientation of the carboxyl terminus of the Na+/proline symport carrier in Escherichia coli, FEBS Lett, 256, 135-138.
- Hanada K, Yamato I, *Anraku Y (1988) Solubilization and reconstitution of proline carrier in Escherichia coli; quantitative analysis and optimal conditions, Biochim Biophys Acta, 939, 282-288.
- Hanada K, Yamato I, *Anraku Y (1988) Purification and reconstitution of Escherichia coli proline carrier using a site specifically cleavable fusion protein, J Biol Chem, 263, 7181-7185. (Open access: http://www.jbc.org/content/263/15/7181.long)
- Hanada K, Yamato I, *Anraku Y (1987) Construction and properties of bifunctionally active membrane-bound fusion proteins. Escherichia coli proline carrier linked with beta-galactosidase, J Biol Chem, 262, 14100-14104. (Open access: http://www.jbc.org/content/262/29/14100.long)
- Hanada K, Yamato I, *Anraku Y (1985) Identification of proline carrier in Escherichia coli K-12, FEBS Lett, 191, 278-282.
関連する他のページ一覧
V. Vero細胞の物語 ~その樹立からゲノム構造の決定、そして未来へ~
花田研究業績(このページ)
その他の記事
花田業績リスト 2016.8.15.更新
・査読のある英文論文のみ記載し
・各論文の責任著者(corresponding author)には名前の左肩に*印をつけた。
・各論文のDigital Object Identifier (DOI)もわかる範囲で加えた。PubMed検索の際に、copy/pasteで当該DOI番号を入力すれば論文の要旨Abstractにすぐにたどり着く。
・自身が責任著者の論文でOpen access(誰でもネットで全文ダウンロード可能)なものはURLを記載した。
・各論文の被引用数(データはGoogle Scholarによる)から求めたh-index = 48 (2016.8.15.時点)
2016年
*Hanada K, and Sugiki T (2016): In vitro assay to extract specific lipid types from phospholipid membranes using lipid-transfer proteins: a lesson from the ceramide transport protein CERT, Neuromethods, in press.
Hernández-Tiedra S, Fabrias G, Salanueva IJ, Casas J, Dávila D, Montes RL, Antón Z, García-Taboada E, Salazar M, Lorente M, Nylandsted J, Armstrong J, López-Valero I, McKee CS, García-López R, Serrano A, Abad JL, Hanada K, Goñi FM, Guzmán M, Lovat P, Jäättelä M, Alonso A, and *Velasco G (2016) Dihydroceramide accumulation mediates cytotoxic autophagy of cancer cells via autolysosome destabilization, Autophagy, in press.
Shirasago Y, Shimizu Y, Tanida I, Suzuki T, Suzuki R, Sugiyama K, Wakita T, Hanada K, Yagi K, Kondoh M, and *Fukasawa M (2016) Occludin-knockout human hepatic Huh7.5.1-8-derived cells are completely resistant to hepatitis C virus infection, Biol Pharm Bull, 39, 839–848. doi: 10.1248/bpb.b15-01023
生物を構成する物質・分子を知り、さらに、それらのもつ機能を知ることで、私たちは生命現象を分子レベルから体系立てて理解できるようになってきました。そして、疾病の発症機構を生体の物質や機能の異常と結びつけて考えることにより、医学や薬学といった人々の健康に関わりの深い分野は大きく発展してきました。
「低分子代謝物、タンパク質や遺伝子といった生体分子の異常」と「疾病の発症」とのあいだに因果関係があるとなれば、生体分子の異常を軽減することで疾患症状も軽減できるような治療法を合理的に開発したり、疾患にかかりやすい傾向にある人の発症を未然に防ぐ・遅らせるといった予防的措置の仕方を見つけたりすることがより容易になるでしょう。
生命科学life scienceの基盤的な研究の成果がすぐに臨床応用に結びつくというものではありません。それでも、疾病の発症の分子メカニズムが解明されていくということは、人間社会への貢献が大きいと思います。何もわからない時に比べて、患者本人や治療者はもとより周囲の人々の誤解にもとづく不適切な対応を減らし、疾病の理解がやがて治療につながるであろうと未来に希望を抱かせる精神衛生上の意義さえもあるのですから。
生化学biochemistryとよばれる学問分野は、歴史の長い生物学biologyや医学medicine (or medical science)と化学chemistryという異なる学術領域をミックスさせた学際的な出自をもつ、比較的あたらしい分野です。ちなみに、生化学分野おいて歴史的も内容的にも最も有名な学術雑誌The Journal of Biological Chemistryの創刊は1905年です。
生化学では、生体のもつ分子(生体分子)の化学構造を決定し、生体中で起こっている化学反応(生化学反応)をひとつひとつあきらかにしてゆくことを勃興当時の中心テーマとしていました。やがて、生化学反応をつかさどる酵素enzymeの本体がタンパク質であることがわかってくると、タンパク質を分離・解析して、タンパク質の機能をあきらかにすることも大きなテーマとなってきました。そして、タンパク質の設計図は遺伝子が担うことも知られるようになり、生化学反応と遺伝子との関連をみいだしてしていくことも生化学が取り組む重要な課題となってきています。また、単離した分子から生命現象を再現する実験系を創出し、その実験系をつうじて複雑な生命現象の仕組みの詳細をあきらかにしていくということも生化学分野における挑戦的な試みです(生命を再現させる試みではありません。あくまで、調べたい生命現象の一部分のみを再現する試みであり、生化学者はこのような実験を再構成reconstitutionとよんだりします)。
生体から取り出した分子を調べてみると、それらは物理法則や化学法則にちゃんと則った挙動をしめすことがわかりました。つまり、生体を構成している分子は、超自然的な神秘をわざわざ考える必要のない「もの」であることが明確になりました。このような知識が人類に与えた影響は大きいと思います。分離した分子を寄せ集めただけで生物を再び作り出すことはできないにせよ、疾病の原因が物質の異常であると理解できれば、「悪霊がとりついている」というような愚かしい理由を病に対して考えることもなくなるはずです。いろいろなことに広く適用できる科学的な知見は、ものごとを合理的に考えるときにとても大切な基礎なのです。
細胞化学部(英名:Department of Biochemistry and Cell Biology)では、生化学のほかに細胞生物学cell biologyの手法や知見も多くもちいていますし、遺伝学geneticsの分野の手法や知見も積極的に取り入れています。
生物の基本ユニットは細胞cellです。よって、生物を知るうえで細胞を詳しく知ることは必要不可欠です。細胞生物学は、生命現象を細胞レベルで解析する学問分野であり、細胞の形態の成り立ちや細胞のもつ機能などを、なるべく生きている細胞を観察しながら知ろうとします。解析対象のタンパク質を蛍光タンパク質fluorescent proteinにつなげて細胞に発現させ、そのタンパク質の挙動を生きた細胞内でリアルタイムに蛍光顕微鏡をもちいて観察できるようになったことは細胞生物学をおおきく進展させました。最近では、蛍光顕微鏡をもちいて一分子のタンパク質の挙動を追跡する技術さえ開発されています。多数の分子の総和平均の観察から解釈されていた生体分子の性質も、一分子ごとに観察してみると、違った様相が表れてくることがあり、これら新しい知見によって細胞の成り立ちをより深く理解できるようになってきています。
しかし、生きている細胞だけを用いて解析するだけでは、なかなか分子メカニズムの解明をめざすには限界がありますので、細胞の形態などはなるべく保ちながらも生物としては死んでいる細胞を解析することもよくあります。そして、細胞レベルの観察でわかってきた細胞内のパーツ(部品)の機能を、細胞を破砕してパーツを取り出して解析する生化学的な手法をも取り入れて確認することも、現代の細胞生物学では、当然のように行われています。また、その逆もあります。すなわち、生化学的に分離した個々のパーツがみせた働きが本当に生体内での働きを反映しているのかを検証する場合、細胞生物学的な手法によって観察される当該パーツの細胞内での挙動とのあいだに説明のつかない不一致がないことを確認したりします。
細胞内の構造をナノメータ(nano meterは、一般の定規の最小目盛であるmmの百万分の1)レベルまたはそれ以下の分解能で観察しようと思えば、光学顕微鏡optical microscope(蛍光顕微鏡fluorescence microscopeも光学顕微鏡のひとつ)ではほぼ無理であり、電子顕微鏡electron microscopeをもちいる必要があります。しかし、生きたままの細胞を電子顕微鏡で観察することは技術的にまだ不可能です。ところで、光学顕微鏡や電子顕微鏡は光や電子線といった波の干渉interferenceや回折diffractionを利用して像をみておりますが、これら従来から生命科学の分野でよく使われてきた顕微鏡とは全くことなる原理をもちいて高分解能観察をする顕微鏡、例えば原子間力顕微鏡atomic force microscope (AFM)、も最近は細胞生物学に導入されつつあります。顕微鏡の原理や最新技術を説明することは私の能力の及ぶところではありませんが、とにかく、微細な構造を観察する手法も日進月歩の勢いで発展しており、そのような手法は細胞の形成機構や細胞のもつ機能を知ることにも大きく寄与しています。なお、高分解能の電子顕微鏡や原子間力顕微鏡などは、たいへん高価な機器ですし、操作も熟練を要することから、専門家のいる研究室で維持管理する必要があると思われます(私たちの研究部には、これら高額機器はありません)。
生命現象を遺伝子geneとむすびつけて考えていく遺伝学は、生命科学のもろもろの研究分野にきわめて大きな影響を与えてきました。19世紀に生きたグレゴール・メンデル(Gregor Mendel, 1822-1884年)によって提示された遺伝法則laws of inheritanceにはじまり、20世紀の「遺伝子の本体はDNAであり、DNA上の核酸配列をもとにタンパク質のアミノ酸配列が決定されている」ということが明らかされる疾風怒涛の時代を経て、2000年から2003年にはヒト全ゲノム配列のドラフト版や完全版が公開されて、現在のゲノム科学genome scienceの興隆にいたっています。これらの流れで培われてきた遺伝子やゲノムに関する知見を無視した生命科学はもはやありえません。チャールズ・ダーウィン(Charles Darwin, 1809-1882年)によって提唱された進化論evolution theoryが正しいことも、遺伝学・ゲノム科学の成果によって疑いようもなく裏付けられたといってよいと思います。もちろん、進化論のアイデアが遺伝学・ゲノム科学の発展に与えた恩恵も大きく、遺伝学・ゲノム科学と進化論は互恵関係の典型といえましょう。
私たちの研究部では、哺乳動物細胞における脂質代謝lipid metabolismを大きな研究テーマとしています。実験材料としては、動物個体ではなく、無限増殖能を獲得した培養細胞culture cellをおもに使い、上で述べたような生化学的手法や細胞生物学的手法をもちいて日常の実験をおこなっています。哺乳動物における脂質代謝の生化学的研究は世界中でおこなわれていますが、当研究部の特徴は、おそらく遺伝学的手法を取り入れているというところにあります。この方向性は、先々代部長の赤松先生、先代部長の西島先生の時代から続いており、私自身もこの方向性に賛同するものでありますが、哺乳動物培養細胞の脂質代謝を生化学と遺伝学とを駆使しながら解析している研究室は世界をみわたしても珍しいと思われます。
ここで私がいう「哺乳動物培養細胞における遺伝学的な手法」とは、研究の対象となる形質character(生物の形状や性質の特徴)に変化のあるような突然変異細胞株mutant cell lineを分離し、この変異株を解析材料として利用する実験手法です。古典的な遺伝学では交配matingしてできた子孫を解析することで形質の遺伝のしかたを知りますが、動物培養細胞では(性細胞sex cell以外での)交配ができません。よって、動物培養細胞から変異株を分離して解析するような分野を特別に体細胞遺伝学somatic cell geneticsとよんだりします。動物個体において、半数体haploidである精子・卵子を性細胞(もしくは生殖細胞germ cell)とよぶのにたいして、そのほかの全ての細胞のことを体の細胞、すなわち体細胞somatic cellとよびます。実験で汎用されている培養細胞のほとんどすべては体細胞に由来していますので、体細胞遺伝学とよばれるわけです。
体細胞では、自然な交配はできませんが、ポリエンチレングリコールpolyethyleneglycol処理によって二個の細胞を人工的に融合することは(細胞の種類にもよりますが)可能です。この細胞融合法を用いて、変異細胞と親細胞parental cellを一個の融合細胞fusion cellにして解析すると、もとの変異細胞のもつ遺伝子変異が親細胞の遺伝子に対して「潜性(劣性)recessive」なのか「顕性(優性)dominant」なのかを知ることができます。融合細胞のしめす形質が、親株に相当するときは「潜性変異」ですし、変異株に相当するときは「顕性変異」と考えられます。
(なお、上述したdominant/recessiveという遺伝学的用語は長らく優性/劣性を邦訳されておりましたが、日本遺伝学会による見直しにより、2017年からは顕性/潜性という邦訳へと改訂されました。本稿もそれに倣い用語を改訂しました[2017.9.20])
また、最近は、RNA干渉interferenceの原理や部位特異的なDNA切断酵素endonucleaseを利用して、特定の遺伝子の発現を減弱させたり、ゲノム上の遺伝子配列を欠失させたりすることが可能になってきています。これらの技術によって、解析対象の遺伝子の欠損が細胞の形質に与える影響を、ある程度「予定が立てられる」実験計画に従って調べることもできるようになりました。
しかしながら、今も昔も変わらぬ高い壁が、二倍体diploidまたはそれ以上の核型をもつ培養細胞の遺伝学には存在します。それは、「広範囲の遺伝子にランダムな変異を起こさせても興味ある形質変化を潜性変異としてもつような変異細胞株を得ることが困難である」ということです。(相同染色体homologous chromosomeがなく、特定の遺伝子は細胞あたりひとつしか存在しない)半数体の細胞を用いた場合に特定の遺伝子における潜性の突然変異出現頻度が100万細胞あたりにひとつとすると、(相同染色体をもつので各遺伝子がふたつずつある)二倍体細胞で相当する潜性変異の形質が現れる頻度は100万X100万(10の12乗!)あたりにひとつと試算され、実験的に変異株を分離することは不可能というような低い確率になってしまうのです。
私たちは、ほぼ二倍体でありながらも潜性変異株の分離例が多いCHO細胞を親株にもちいることで、複数の重要な脂質代謝変異株を得ることに成功し、これらを独自の実験材料として有効に利用してきました。生化学と遺伝学を組み合わせた研究手法(それを遺伝生化学的アプローチと私たちはよんでいます)こそが、当研究部の独自性originalityを培ってきたことは間違いありません。そのいくつかの実例は、別項で詳しく述べます。
上で少し述べましたように高性能DNAシ-ケンサの普及や新しいゲノム編集技術の登場により、哺乳動物培養細胞に対する遺伝学的な解析の幅は急速に充実されつつあります。このような変化を受けて、感染症対策に資する宿主細胞側からの重要な情報や実験材料を提供する研究にも取り組んでいます。そのような方向性の研究を展開する準備の一つとして、微生物学研究だけでなくワクチン生産においても広く使われているアフリカミドリザル腎臓由来Vero細胞の全ゲノム配列を他機関との共同研究により、世界に先駆けて決定しました。この話題も、別項で詳しく述べています。
「広範囲の遺伝子にランダムな変異を起こさせても興味ある形質変化を潜性変異としてもつような変異細胞株を得ることが困難である」と上述しましたが、実はこの問題もゲノム編集技術genome-editing technologyの急速な発展によって部分的には解決されつつあります。ゲノム上の遺伝子を網羅したような編集ツール(例えばレンチウイルスベクター上に構築されたゲノムワイドのCRISPR/Cas9ガイドRNAライブラリ)がヒトやマウスといった生物種に対しては開発されています。そして、このような新ツールを用いて「広範囲の遺伝子にランダムな変異を起こさせた」時には、特定の遺伝子に複数の対立遺伝子allelesがあってもそれら全てのallelesを欠失させて潜性変異の表現型を持った細胞株が得られることがあります(それも、一つの変異細胞株を得るのに多大な労力を払った過去を持つ私にはまさに驚愕すべき高い頻度で!)。私たちは、HeLa細胞を含めたいろいろなヒト培養細胞でこの新ツールを用いて感染症研究に資する変異細胞パネルやライブラリの作製に取り組んでいます。
学問領域というものはもともと曖昧でありますし、字面上は異なる学問分野といえども多分にお互い関連し合っています。生命科学は、あらたに生まれてきた学術分野領域を含めてさまざまな分野の手法や知見を統合させながら協力し、猛烈な勢いで進展しております。とはいえ、ひとりの研究者やひとつの研究部が対応できる守備範囲は限られています。当研究部では、生化学、細胞生物学それに体細胞遺伝学と一般によばれる分野での手法や知見を主たる基盤とし、足りない部分は部外の他の領域の専門家と協働しながら、日々の研究を進めています。
花田賢太郎(感染研 品質保証・管理部、細胞化学部併任)
(2013年2月19日)(2015年6月19日、一部追加)(2015年7月21日、一部追加とともに重複部分削除)(2021年4月1日 所属更新)
I. 私の志向する生化学、細胞生物学,そして体細胞遺伝学(このページ)
V. Vero細胞の物語 ~その樹立からゲノム構造の決定、そして未来へ~
その他の記事
1.はじめに
生物は,どのようにしてそのダイナミックな秩序を生み出して維持しているのでしょうか?そのためには少なくとも、あるべき物を,あるべき時に、あるべき場所へ配置するシステムが備わっていなければならないはずです。このシステムの成り立ちを分子レベルで明らかにすることこそが現代生物学の主流であると私は思っています。
物質代謝という古典的とみなされがちな研究分野でさえ、上に提起した問題はじゅうぶん解き明かされているわけではありません。とくに「場所」の問題は,細胞内のようなミクロな場に対しての良い解析手段が限られていることもあり、多くのことが未解明です。
ヒトからカビにいたるまで、よく目にする生物のほとんどは、染色体chromosomeをしまっている核nucleusとよばれる構造をもつので、真核生物eukaryotesに分類されます。真核生物の細胞には、核以外にも膜で囲まれたさまざまな細胞内小器官(オルガネラorganelle)が存在します。真核細胞においては、小胞体endoplasmic reticulumが脂質合成の最重要拠点であり、小胞体で合成されたさまざまな脂質は、それぞれにことなるオルガネラへと移動しています。膜タンパク質が小胞体から別のオルガネラへ移動するときには、もっぱら輸送小胞transport vesiclesとよばれる小さな膜の包みに乗って動くことがよく知られている一方で、小胞体で合成された脂質は、輸送小胞を利用せずに目的地へと移動しているらしいことが指摘されていました。しかし、その実態はなかなかわからずにいました。
私たちは、この生物の基本的な問題に、独自のアプローチをもちいて長いあいだ取り組んできました。その成果として、脂質セラミドceramideが小胞体からゴルジ体Golgi apparatusへと選ばれて輸送されるときに重要な働きをする遺伝子とそのタンパク質産物を2003年に発見しました。これらの発見などが突破口となって、オルガネラ間の脂質選別輸送interorganelle lipid traffickingの研究もようやく分子メカニズムに迫れる時代に突入してきています。以下、私たちが行っている脂質選別輸送に関する研究のあゆみを詳しくご紹介します。
2.細胞内の脂質選別輸送
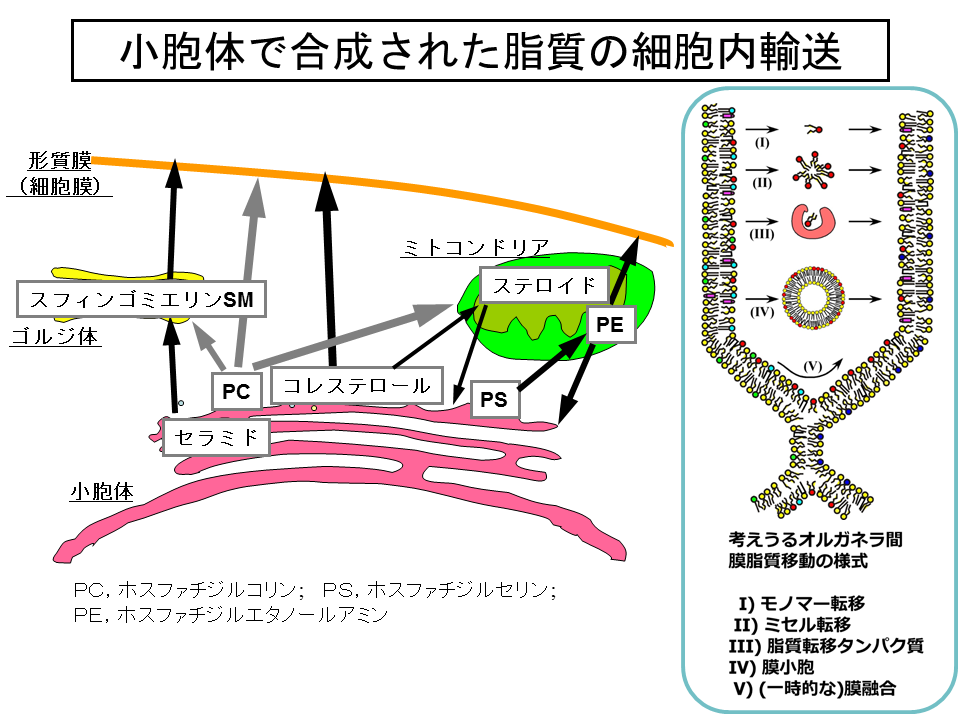
真核細胞における膜脂質の生合成では、ことなるオルガネラの膜でおきる複数の代謝ステップを経ることがしばしば必要となります。たとえば、小胞体で合成されるリン脂質phospholipidのひとつであるホスファチジルセリンphosphatidylserineは、ミトコンドリアmitochondriaへと移動し、そこで脱炭酸反応を受けて、もうひとつの主要な膜リン脂質であるホスファチジルエタノールアミンphosphatidylethanolamineへ変換されます(図1)[1]。
図1
また、生合成的には最終産物となっても、生産の場からほかの膜系へと移動することが、それぞれの脂質の働きに必要な場合もあります。たとえば、コレステロールcholesterolは、小胞体で合成されたのちに、おもに形質膜plasma membrane(細胞膜cell membraneともいう)へと速やかに移動して形質膜の機能をコントロールする役割をはたしています(図1)[1, 2]。
核という細胞内構造をもたない原核生物prokaryotesすなわち細菌は、細胞の表面にしか膜系がありません。細菌の表層envelopeは、通常、内膜と外膜とよばれる二つのリン脂質膜系から成り立っています。細菌では、脂質の生合成はもっぱら内膜でおきていますので、外膜形成のためには、内膜で合成された脂質が外膜に移らねばなりません。グラム陰性細菌Gram-negative bacteriaの表層構成因子であるリポ多糖lipopolysaccharidesも内膜で生合成されたのちに、最終目的地である外膜へと移動しています[3, 4]。
では、どのようにして、特定のオルガネラ膜にあるさまざまな脂質のなかから特定の脂質を選びだしてほかのオルガネラ膜へと運んでいるのでしょうか?その様式として、図1の挿入図にあるような五つのメカニズムが推定されていましたが、実際にどのような様式で運ばれているのかは、どの種類の脂質をとってみても、また、どの種類の細胞をとってみてもほとんどわからないままでした。
当研究部では、哺乳動物細胞におけるスフィンゴ脂質sphingolipidの代謝と機能の研究を突然変異細胞株mutant cell linesを利用して進めています。そのなかで、セラミドが小胞体膜からゴルジ体膜へと選択的に運ばれる際に中心的な役割をするタンパク質をみいだしました。小胞体膜からゴルジ体へのセラミド輸送は、細胞内の脂質選別輸送のモデル系として、その研究成果が少しずつほかの研究分野へも波及するようになってきています。
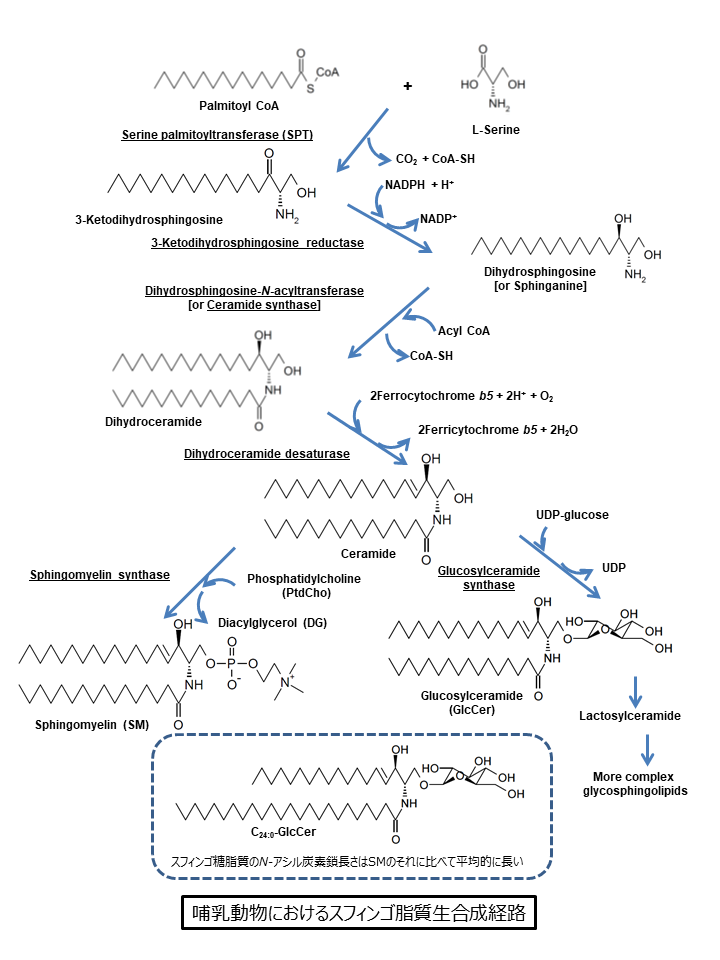
3.スフィンゴ脂質の生合成経路とオルガネラ間の移動
スフィンゴ脂質の生合成では、セリンパルミトイル転移酵素(serine palmitoyltransferase;SPT)が触媒するセリンとパルミトイル palmitoyl CoAとの縮合反応からはじまり、いくつかの反応を経てセラミドとなります(図2)[5, 6]。哺乳動物細胞においては、セラミドはさらにスフィンゴミエリンsphingomyelinもしくはグルコシルセラミドglucosylceramideへと変換され、グルコシルセラミドはさらに複雑なスフィンゴ糖脂質へと変換されます(図2)。この際、セラミド合成までは小胞体膜上の細胞質側の表面でおこりますが、 スフィンゴミエリンやスフィンゴ糖脂質の合成はゴルジ体でおこると考えられています。したがって、スフィンゴミエリン合成の際には、セラミドは小胞体からゴルジ体に移動しなければならないはずです(図1)。

図2
なお、グルコシルセラミド合成でもセラミドのゴルジ体への移行が必要と考えられておりますが、グルコシルセラミド合成酵素glucosylceramide synthaseの一部分は小胞体にも分布しているという報告もあり[7, 8]、グルコシルセラミドの新合成が小胞体上でおこっている可能性もあります。その場合、グルコシルセラミドがさらに複雑なスフィンゴ糖脂質へと変換するために、グルコシルセラミド分子はゴルジ体に移動するはずです。グルコシルセラミドのおもな合成の場所、そこへのセラミドの分配やグルコシルセラミド分子が次の代謝の場へ移動するメカニズムは本稿を書いている2013年の時点でもよくわかっておりません。
4.細胞内セラミド輸送が欠損している突然変異細胞株
縞ミミズEisenia foetida(釣り餌やミミズコンポストの用途で使われる細いミミズです)の体腔液からもともとは血管収縮を誘導する作用のある物質として分離され、そののちに、細胞表面上のスフィンゴミエリンに結合して膜に孔をあける細胞溶解活性のあることが判明したタンパク質がライセニンlyseninです。ライセニンは、その精製と遺伝子クローニングから蛍光プローブをつけた誘導体作製にいたるまでおもな研究成果を日本の研究グループが挙げ世界に広がっています[9-12]。
1996年のはじめころ、梅田真郷先生(当時の所属は東京都臨床研、現在は京大院・教授)から、「スフィンゴミエリン結合能と細胞溶解活性があるタンパク質(その当時はeiseninという名でよばれていた)をみつけたが、スフィンゴミエリン分解活性があるかどうかを測定してほしい」との依頼をうけました。私たちにはスフィンゴミエリン分解酵素の活性測定系がありましたので、いただいたサンプルで測定したところ、そのような活性はありませんでした。このタンパクにさらすと、正常細胞は速やかに死滅しましたが、私たちで分離したスフィンゴ脂質全般の合成を失った変異細胞はすべて生き残ることを観察しました[13]。さらに、正常細胞であっても、精製したスフィンゴミエリン分解酵素で処理すれば、ライセニンに耐性となることもみつけました[13]。これらの観察から、ライセニンはスフィンゴミエリンを分解して細胞を殺すのではなく、膜に孔を開けて細胞を溶解させるpore-forming cytolysinの一種であり、膜に結合するにはスフィンゴミエリンが必要なのだということが確認できました。
そこで、「ライセニンで処理をしても生き残る」という簡便な選択方法によってスフィンゴミエリン代謝に異常がある新しい変異株を得られるのではなかろうかと期待し、チャイニーズハムスター卵巣から樹立された培養細胞であるCHO-K1細胞を親株として、ライセニン耐性を示す変異株を40 株ほど分離しました。その際に得た変異株の一つが、LY-A株と名付けた変異株です[13]。(章末の余談1も参照)
LY-A細胞では、 スフィンゴミエリンの新合成de novo synthesisの速度および含有量がともに低下しているものの、スフィンゴミエリン代謝に関する酵素活性には異常は認められず、脂質輸送の段階に欠損があるのではないかと疑われました。当時、小胞体からゴルジ体へとセラミドを輸送する活性を検出する実験手法はなかったため、以下のように自分たちで模索した検証方法によって、この疑問に答えました。
ブレフェルジンA (brefeldin A, BFA)という薬剤で細胞を処理すると、小胞体とゴルジ体とが融合することが知られています。もし、小胞体とゴルジ体のあいだのセラミド輸送の異常によりスフィンゴミエリン合成が低下しているのなら、BFA処理で小胞体とゴルジ体を融合させてしまえば、スフィンゴミエリン合成の低下はもはやみられなくなるであろうと予測されます。実際にやってみるとこの予想とおりになり、BFA 処理後のスフィンゴミエリン合成はLY-A細胞と親株CHO-K1細胞とのあいだでほぼ等しくなりました[14]。この観察により、私たちは、LY-A細胞でもスフィンゴミエリンを合成する酵素はちゃんと機能しており、小胞体で合成されたセラミドがスフィンゴミエリンへ変換するゴルジ体へ移動するプロセスに異常がおきているらしいことを知ることができたわけです。このことをさらに別の実験でも検証しました。
C5-DMB-セラミドは、蛍光団をもった人工のセラミド類似化合物です(図3)。細胞を低温でC5-DMB-セラミドにさらすと、この化合物は形質膜を通過し、細胞中のオルガネラ膜を蛍光標識します。この標識細胞を生理的な温度にもどすと、蛍光がゴルジ体領域に集まってくることが知られており、この現象は小胞体で合成された天然型セラミドがゴルジ体へと移動することを反映したものであろうと推定されていました[15]。親株とLY-A株でC5-DMB-セラミドをもちいたそのような実験を行うと、ゴルジ体領域への蛍光の集積がLY-A株では遅くなっていることが観察されました(図3)[14]。
図3
これらの結果から、私たちは、セラミドの小胞体からゴルジ体への移行がLY-A株では欠損していると結論しました[14]。
5.セラミド選別輸送の再構成実験系の樹立
ものごとをいちど分解してからそれを再構築してみることは、ものごとの仕組みを知るうえでとても有効です。細胞のなかでおきている脂質輸送という仕組みを知りたいのであれば、細胞を分解しつつも生細胞のなかでおきているその事象のすべてではないにせよその重要な一部分を再現できる実験系を編み出すことは、研究を飛躍させるためには是非とも越したい大きな関門であります。
私たちは、小胞体からゴルジ体へのセラミド輸送を生細胞以外で観察できるようにすることに挑戦しました。そして、セラミド→スフィンゴミエリン変換の速度、温度依存性、そして親株CHO-K1細胞と変異株LY-A細胞との差といったさまざまな点において無傷の細胞で観察される事象をよく再現する再構成系reconstitution systemを樹立することができました[16]。
この実験系では、形質膜に小孔をあけて細胞質cytosolを抜いてしまった開孔細胞中で放射性同位体で標識された[3H]セラミドを合成させたのち、細胞質画分やATPを加えて、37℃で保温します(図4)。37℃で保温時の[3H]セラミドから[3H]スフィンゴミエリンへの変換が、小胞体-ゴルジ体間セラミド輸送の指標となります。
この再構成実験系において、セラミド→スフィンゴミエリン変換は細胞質の添加を必要としました。さらに、LY-A細胞の再構成では欠損しているセラミド→スフィンゴミエリン変換は、細胞質画分だけでも親株由来のものに交換すると回復することから(図4)、セラミド輸送にかかわる細胞質因子がLY-A細胞では欠損していることがわかりました[16]。スフィンゴミエリン合成酵素sphingomyelin synthase活性には、細胞質依存性はありませんでしたし、タンパク質の小胞体からゴルジ体への輸送はLY-A細胞でも正常であったので、LY-A細胞で欠損しているのは、セラミド輸送に特別に必要な遺伝子産物であると考えられました[14]。
図4
自分たちで分離していた変異株LY-Aの存在が、この再構成実験系を樹立するうえでとても重要でした。私たちはもともと、「親株CKO-K1細胞と変異株LY-A細胞との差が再現できる」ということを再構成が成功したと判断する一番目の基準としておりました。よって、なにかしらのシグナルは検出できても、この基準に合わずに捨て去られた試作系もあります。そもそも、分子メカニズムがわかっていない生物学的事象の再構成などという不遜な企ては、適切な評価系がなければすぐにでも間違った道に迷い込んでしまうものなのです。私たちは、LY-A細胞のおかげで、自分たちが試作した実験系をそのつどに評価しながら信頼のおける再構成系へと到達することができたといえます。このセラミド選別輸送の再構成系は、そののちもいろいろな場面で活躍しています。
次いで、 LY-A株の欠損因子の同定を試みました(本当は、「次いで」ではありません。遺伝子クローニングは変異株がとれてまもない1998年中にはすでに挑戦しはじめており、再構成系の作製などと一緒に同時並行的に試行錯誤していたのが実状です)。
6.LY-A株を回復させる遺伝子cDNAのクローニング
6−1.回復株を選択するための条件さがし
LY-A株と親株CHO-K1細胞との融合させた細胞におけるスフィンゴミエリン合成は、CHO-K1細胞のそれとほぼおなじでした。この観察の意味するところは、「LY-A細胞におきている遺伝子変異は正常な遺伝子とおなじ細胞中で共存した場合には、細胞が正常な性質を表すような変異である(このような変異を「劣性変異」とよびます)」ということです。であるのならば、LY-A細胞に正常型の遺伝子すべてをひとつずつLY-A細胞に発現させていけばどこかでLY-A細胞の欠損を回復させる遺伝子に行きつくはずです。それには、数万種類以上の遺伝子を導入したLY-A細胞集団から回復細胞をうまく選びだせるかどうかがキーポイントになります。しかし、ライセニン感受性にもどった細胞をライセニン処理したのちに選択するというやりかたでは、選択したい回復細胞をライセニン処理中に殺してしてしまい細胞を回収できないため使えません。私たちが前に進むには、「LY-A細胞は死滅させるが回復株は生き残る」という選択条件をあらたにみいだす必要がありました。
スフィンゴミエリンとコレステロールは、ともに形質膜におもに分布しています。そして、人工脂質膜をもちいた実験から、コレステロールはグリセロリン脂質glycerophospholipidsに比べてスフィンゴミエリンとより強い物理的相互作用をすることが知られていました。私たちは、コレステロール結合試薬・メチルシクロデキストリンmethyl-beta-cyclodextrinに細胞をさらした場合、LY-A細胞のようなスフィンゴミエリン含有量の低い細胞ほどコレステロールが速やかに失われて死滅することをみいだしました[17]。これで、LY-A細胞に外来遺伝子を導入したあとにメチルシクロデキストリン処理し、生き残った細胞から外来遺伝子を回収するという方向性でLY-A細胞で欠損している遺伝子を探しだす道が開けました。
実際には、効率的なレトロウイルスベクター系を利用するなどのさらなる工夫が必要でした。安定かつ効率的な遺伝子導入に使うことができるマウス欠損レトロウイルスにCHO細胞は感染しません。その受容体がないからです。そこで、当該ウイルスの受容体であるマウス・カチオニック・アミノ酸トランスポーター1(mouse cationic amino acid transporter 1; mCAT-1)をLY-A株に安定発現させたLY-A亜株を作製し、それにレトロウイルスベクター上に構築したヒトcDNAライブラリー(これは市販のものを利用しました)から調製したウイルス粒子を感染させるという方法へと切りかえるまで目的遺伝子にはたどり着けませんでした。このとき、東京大学医科学研究所の北村教授らによって開発されたレトロウイルス粒子生産用パッケージ細胞Plat-Eを使わせていただけたことは幸いでした。
6−2.LY-A株で欠損している遺伝子の同定
遺伝子導入の工夫とみいだした選択条件をもちいて、私たちはLY-A株の欠損を補う遺伝子cDNAをクローニングすることに成功しました[18]。本cDNAをLY-A株に導入すると、しらべた範囲内ですべての性質が親株CHO-K1細胞のレベルに回復しましたので、この遺伝子cDNAがコードするタンパク質はceramide traffickingにちなんでCERTと命名することにしました[18]。
LY-A細胞のCERT遺伝子にはアミノ酸変異をともなう一塩基置換変異が起こっており、この変異型CERT cDNAの導入ではLY-A細胞はちゃんと回復できないこともわかりました[18]。
LY-A細胞を見かけ上でも回復させるようなCERT以外の分子を見つけられないかと、上記のスクリーニングをCERT発見のあとも繰り返したのですが、もう一度CERT cDNAがクローニングされただけに終わりました。はからずもこのスクリーニング系の「再現性」を確認してしまったことになります。
6−3.CERTとおなじ遺伝子産物GPBPΔ26
CERTとアミノ酸配列がおなじ遺伝子産物は、Goodpasture-antigen binding protein (GPBP)のスプライス異性体splice variantであるGPBPΔ26という名ですでに知られていました。
グッドパスチャー症候群Goodpasture’s syndromeというのは腎臓や肺の基底膜に対する自己抗体ができて死にもいたる重篤な自己免疫疾患です。この自己免疫疾患の抗原すなわちグッドパスチャー抗原Goodpasture antigenは、ヒト・4型コラーゲン・アルファ第3アイソフォーム(Type 4, collagen alfa3; COL4A3)のカルボキシル末端にある非コラーゲン部分であることが知られています。このCOL4A3の非コラーゲン部分に結合してこれをリン酸化するタンパク質キナーゼとしてGPBPおよびGPBPΔ26(GPBPのエキソン一つ分の26アミノ酸がないスプライス異性体)をスペインのSaus博士らの研究グループが報告していたのです[19, 20]。(章末の余談2も参照)
GPBPおよびGPBPΔ26は、グッドパスチャー症候群という病的な状態に関わるかもしれない細胞外キナーゼとして報告されていますが、通常のタンパク質キナーゼならもつようなキナーゼドメインがみあたりません[19, 20]。また、これらのタンパク質は、明瞭な分泌シグナル配列がなくて細胞質に多く分布するというのにもかかわらず、細胞外マトリックスであるコラーゲンに結合するということも不思議な観察であり、健常なヒトにおいては細胞内での役割が本業である可能性もありました。
私たちは、次の項で説明するように、このタンパク質の本来の役割は細胞内のセラミド輸送であることをみいだしたので、名が体をあらわすべくCERTという新しい名前をGPBPΔ26に与えました。GPBP(CERTのlarge variantということでCERTLと私たちはよんでいます)も、セラミド転移活性はCERTとおなじように観察されています[18]。(章末の余談3も参照)
なお、ヒトゲノム遺伝子として最初に登録された名称は、Collagen type 4 alfa 3-binding proteinとしてみつかったGPBPに由来するCOL4A3BPですので、CERT配列を各種生物ゲノムでホモロジー検索するとヒトCOL4A3BPホモログとして表示されます。セラミド輸送も注釈としてついておりますが。
その後、本遺伝子は、コラーゲン結合因子というよりもセラミド輸送タンパク質として様々な研究者に引用されました。その事情を察知したHuman Genome Organization (HUGO)のGene Momenclature Committee (HGNC)は、このヒト遺伝子の正式なシンボルをCERT1 に変更すると2019年6月に決定しました。それ以降、NBCI上での正式命名表示(https://www.ncbi.nlm.nih.gov/gene?Db=gene&Cmd=DetailsSearch&Term=10087)も含めてCERT1へと変更されてきています。
7.小胞体からゴルジ体へのセラミドの選別輸送を担う分子装置CERT
CERTは、68 kDaの親水性タンパク質であり、そのほとんどは細胞質に分布しますが、一部はゴルジ体にも会合しています[18] 。CERTを解析すると、複数の機能領域をもつことでセラミドの小胞体からゴルジ体への選別輸送を自身で担えるようなタンパク質であることがあきらかとなってきました(図5)[18, 21, 22]。
図5
7−1.ゴルジ体へのターゲットに必要なPHドメイン
CERTのアミノ末端領域の約100アミノ酸は、リン酸化イノシトール脂質phosphoinositidesを結合するプレクストリン相同pleckstrin homology (PH)ドメインを形成しています。このPHドメインは、さまざまなリン酸化イノシトール脂質のなかで、ホスファチジルイノシトール-4-一リン酸phosphatidylinositol-4-monophosphate (PtdIns4P, PI4P)を特異的に結合しました[18]。PtdIns4Pは細胞内では主にゴルジ体およびトランスゴルジ網trans Golgi networkに分布しており、PtdIns4Pを特異的に結合するPHドメインはゴルジ体へのターゲットシグナルとして働きます[23, 24]。
LY-A細胞と親株のCHO-K1細胞からそれぞれ内在性CERTのcDNAをクローニングして比べたところ、PHドメイン内のグリシン残基がLY-A株由来CERTではグルタミン酸に置換(G67E変異)されていました。この置換のため、LY-A株由来のCERTはPtdIns4P結合能を失い、それが原因でゴルジ体到達能も失っていました[18]。
2012年にCERTのPHドメインの三次元構造が解かれ、このPHドメインがゴルジ膜を選択的に認識できる仕組みがさらにわかってきています[24](この紹介は別途してゆきたいと思います)(簡単な紹介はこちら)。
7−2.セラミドの引き抜き転移活性をもつSTARTドメイン
CERTのカルボキシル末端領域の約230アミノ酸は、膜のあいだの脂質の転移をおこなうと推測されるSTARTドメインを形成しています[25]。人工のリン脂質膜をもちいた実験から、CERTのSTARTドメインは、膜からセラミドを特異的に引き抜き、1:1複合体を形成し、結合したセラミド分子を別の膜に移す活性をもつことがあきらかになりました[18, 21]。CERTのSTARTドメインは、セラミドに対して選択性が高く、スフィンゴシンやスフィンゴミエリンの転移活性はまったくありませんでした。セラミドに化学構造が比較的似ているジアシルグリセロールdiacylglycerolの膜間転移の活性でも、セラミドに対する活性の5%くらいでしかありませんでした[18, 21]。私たちは、哺乳動物細胞における典型的な天然セラミド分子である(アミド結合脂肪酸がC16パルミチン酸の)C16-セラミドをもちいて通常は解析していますが、C16-セラミドの天然にある異性体分子(ジヒドロセラミドdihydroceramideやフィトセラミドphytoceramide)や脂肪酸鎖長さの違ういろいろなセラミド分子もC16-セラミドとおなじように転移させることも観察しています[21]。
このような基質認識の特異性と融通性とを併せもつ仕組みも、CERTのSTARTドメインとセラミドとの共結晶の解析によって、原子レベルでわかってきています[26-28](これについての紹介も別途する予定です)。
7−3.小胞体との相互作用にかかわるFFATモチーフ
PHドメインとSTARTドメインのあいだの約260アミノ酸からなる中間領域(middle region; MR)は、既知のドメインには該当するものがありません。しかし、小胞体膜タンパク質であるVAPに結合すると報告されたペプチドモチーフ(FFATモチーフと名付けられている)が存在しています[29](図5)。CERTはこのFFATモチーフに依存してVAPに結合すること、そして、FFATに変異がおきると、CERTの小胞体-ゴルジ体セラミド輸送機能がそこなわれることがわかりました[22]。
8.小胞体からゴルジ体へのセラミドの選別輸送のメカニズム
上で述べたような実験結果から、CERTは小胞体からゴルジ体へとセラミドを輸送する分子であると私たちは結論し、その分子メカニズムとして「脂質分子引き抜き転移モデル」を提唱しました(図6)[30-33]。
このモデルでは、つぎのような素過程の繰り返しでセラミドが運ばれるとしています: (1) CERTがVAPとの相互作用を介して小胞体と一時的に会合し、(2) 小胞体膜から特異的にセラミドを引き抜いて、CERT/セラミド1:1複合体を形成する、(3) CERT/セラミド複合体は、小胞体からPtdIns4Pの豊富なゴルジ体領域に選択的に到達し、(4)セラミドをゴルジ体膜へ受けわたし、そして、(5)はじめのステップ(1)に戻る。
図6
CERTを発見した当初から予想されていることですが、CERTが介するセラミドの小胞体からの引き抜きとゴルジ体への転移は、小胞体全体で均質におこっているというよりも、小胞体とゴルジ体が近接した特別な領域でおこっているようです。
小胞体の英語であるendoplasmic reticulumを直訳すると「細胞(質)内の網目構造体」となります。小胞体は、その名の通り細胞質全体に網目のように広がる膜構造であることから、ほかのオルガネラに近接しうると想像されます。実際、小胞体の一部分は、偶然にほかのオルガネラと近接するにとどまらず、(タンパク質のサイズレベルである)10-30 nmくらいの距離で接触していることがいろいろな細胞でしめされております[34, 35]。ゴルジ体膜との接触にかんしては、ゴルジ体のなかのトランス嚢trans cisternaが特異的に小胞体と接触していると考えられています[36]。
このようなオルガネラ膜接触部位organelle membrane contact sitesがになう役割についていくつかの事柄が提唱されており、そのなかでも脂質やカルシウムイオンなど低分子のオルガネラ間移動へのかかわりが特に注目されています[34, 37-39]。
もし、出発地と到着地が近接した小胞体-ゴルジ体接触部位でセラミドの引き抜き転移がおこるのであれば、素早いシャトルが可能になるでしょう(図6)。CERTは両方の膜に同時に結合しながらSTARTドメインを首振り運動のように動かし、セラミドを小胞体から引き抜いて、ゴルジ体へと移しているのかもしれません(図6)。
CERTとVAPをおなじ細胞中で高レベル発現させて細胞内分布を観察すると、CERTの濃縮するゴルジ体領域にVAPもわずかながら共局在co-localizationされるように観察されます[22]。VAP結合能をうしなったCERT変異体をもちいた場合ではCERTはゴルジ体領域に濃縮されながらもVAPの共局在はおきません[22]。これらの観察は、PHドメインを介してゴルジ体と結合しているCERTは、自身のもつFFATモチーフをもちいて小胞体のVAPとも同時に結合しうることを示唆しています。このことは、図6のような小胞体-ゴルジ体接触部位でCERTが働くとするモデルを支持する結果といえます。
ゴルジ体領域においてグルコシルセラミド合成酵素は、スフィンゴミエリン合成酵素よりもシス側(小胞体からのタンパク質輸送の入り口に近い方)に存在しているので、タンパク質輸送とおなじ経路でセラミドが運ばれているのなら、小胞体で合成されたセラミドはグルコシルセラミド合成酵素に先に到達してそこで優先的に使われてしまうと想像されます。しかし、実際のスフィンゴ脂質生合成では、糖脂質よりもスフィンゴミエリンの合成により多くのセラミドが消費されています。上で紹介した分子引き抜き転移モデルに立てば、 CERTを介して小胞体から移動するセラミド分子は、シスゴルジ領域のグルコシルセラミド合成部位を飛び越えて、ゴルジ体トランス領域にあるスフィンゴミエリン合成の場へと到達すると説明することができます。
9.CERT機能の制御機構
9−1.CERTの多重リン酸化領域SRMとそのリン酸化による負の制御
抗原ペプチド配列を付けたCERTを培養細胞に発現させて、ウエスタンブロット解析するとポリアクリルアミドゲル電気泳動で分離できる程度に位置がずれた二重のバンドとして検出されます。細胞破砕液をタンパク質脱リン酸化酵素処理するとこの二重バンドは一つのバンドに収束することから、CERTはリン酸化修飾を受けると考えられました。そこで、ヒト子宮頸ガン由来株化HeLa-S3細胞に抗原ペプチド配列を付加したCERTを発現させて、それを抗体クロマトグラフィー法で精製し、定法に従って質量分析したところ、約30アミノ酸の長さの配列中に10個あるセリン・スレオニンのすべてがリン酸化されている領域をみつけ、この多重リン酸化領域をserine repeat motif (SRM)と名付けました(図7)[40]。
SRMにあるセリン・スレオニン10個すべてをグルタミン酸に置換した疑似多重リン酸化変異体・CERT 10Eおよび当該領域がリン酸化されないような変異体・CERT S132Aと野生型CERTとを比べたところ、
i) 小胞体からゴルジ体へのセラミド輸送能においてCERT 10Eはほとんど活性を示さず、逆に CERT S132Aは野生型CERTよりも高い活性がある、ii) CERTのアミノ末端領域にあるPHドメインの活性(すなわちPtdIns4P結合活性)とカルボキシル末端領域にあるSTARTドメインの活性(すなわちセラミド転移活性)の両方がCERT 10E変異体では低下しており、逆にCERT S132Aでは高進していることがわかりました。さらに、CERT 10EのPHドメインのみを切り離すとSTARTドメイン活性が回復し、逆にSTARTドメインのみを切り離すとPHドメイン活性が回復しました[40]。
これらの観察をもとにして次のようなモデルを提案しました(図7)。すなわち、SRMが多重リン酸化すると、CERTがコンフォメーション変化をおこして、PHドメインとSTARTドメインがお互いをマスクするようになって両方のドメイン活性が抑制されるというものです[40]。
SRMのリン酸化状態は、スフィンゴ脂質合成を阻害したり、スフィンゴミエリンを強制的に分解したりすると脱リン酸化の方向に変化しました[40]。細胞のコレステロールを減らすような処理をしてもおなじように脱リン酸化傾向にありました[40]。これらの観察は、スフィンゴミエリンとコレステロールが共同して形成している生体膜の環境が破壊されるとCERTのSRMが脱リン酸化されて、CERTの機能としては高進する(スフィンゴミエリンをより多く合成する)ように仕組まれていると解釈できますものの、どのようにしてそのような一連の反応がおこるかのメカニズムはまだわかりません。
図7
ほぼ同時期に海外のグループからも、CERTのS132がタンパク質リン酸化酵素D (protein kinase D; PKD)によってリン酸化されるとCERTのPtdIns4P結合活性とセラミド転移活性の両方が低下するという論文が出ています[41]。CERTの似たような解析をしているほかのグループがいたことに驚かされました。この研究グループは、PKDのゴルジ体へのかかわりを中心に調べているグループであり、PKDの認識部位になりそうなCERTのS132に注目した参入だったようです。
ちなみに、HeLa細胞に発現させた野生型CERTは細胞質とゴルジ体領域の両方に分布しますが、常時活性型constitutive active formともいえるCERT S132A変異体はゴルジ体領域に局在するようになります。常時不活性constitutive inactive(または低活性)型であるCERT 10Eはゴルジ体への分布がほぼ消滅します[40]。これらの観察は、活性型CERTはゴルジ体領域に局在しながら働いていることを示唆しており、小胞体-ゴルジ体膜接触部位がCERTの働く場であることを支持する観察と私たちは考えています。
9−2.CERT SRMの多重リン酸化に関与するキナーゼの同定
スフィンゴミエリン合成を抑制するような因子を知りたいと、遺伝子を過剰発現するとスフィンゴミエリン結合性の細胞融解毒ライセニンに対して耐性を与えるcDNAをスクリーニングし、細胞内のおもなリン酸化酵素のひとつであるカゼインキナーゼ1ガンマ2(casein kinase 1 gamma 2; CK1g2)によってスフィンゴミエリン生合成が抑制されることを私たちはみいだしました[42]。その際、スフィンゴミエリン合成酵素活性は影響を受けていませんでした。カゼインキナーゼ1はアミノ酸2-3個おきに並ぶセリン・スレオニンを連続的にリン酸化する酵素です。結局、CK1g2は上で述べたCERTの多重リン酸化領域SRMをリン酸化することでCERT活性を抑制することがあきらかとなりました(図7)[42]。
9−3.CERTの脱リン酸化に関与する酵素
タンパク質脱リン酸化酵素protein phosphataseの研究で著名な東北大の小林先生・田村先生たちのグループは、Protein phosphatase 2C epsilon (PP2Ce)と結合するタンパク質の一つとしてVAPがあることをまずみいだし、さらに、VAPと会合することがあるCERTの脱リン酸化にPP2Ceかかかわっていることもしめしました(図7)[43]。これには私たちも共同研究として参画させていただきました。
9−4.CERT S315のリン酸化とVAPとの会合
SRM以外の箇所でもCERTはリン酸化を受けており、それも機能制御に重要であることも明らかになりました。タンパク質の質量分析の発展はすさまじく、2000年代中盤には細胞中のタンパク質のリン酸化部位を網羅的に同定するということが可能になってきました。Olsenらは上皮成長因子epidermal growth factor (EGF)刺激がもたらすタンパク質リン酸化ネットワークを知るため、HeLa細胞をEGF刺激して後経時的にリン酸化ペプチド断片を約2000のタンパク質を網羅しながら解析しました[61]。その論文データの中にCERTの315番目のアミノ酸残基であるセリン315 (S315)がリン酸化を受けている実証的証拠が記載されていました[61]。S315はFFATモチーフのすぐ上流にあります。我々は、S315のリン酸化がFFATモチーフの機能に影響するという作業仮説を立て、S315リン酸化型CERTに対する抗体やCERTの各種アミノ酸変異体を用いて解析を行いました。その結果、S315がリン酸化するとCERTのFFATモチーフ依存性のVAP結合活性が顕著に増強することを通じて、CERTのセラミドの小胞体-ゴルジ体間輸送機能も高進することを見出しました[62] (簡単な説明はこちら)。S315のリン酸化はPHドメインが担うPtdIns4P結合能やSTARTドメインの担うセラミド転移活性にはほとんど影響を及ぼさず、SRMのリン酸化・脱リン酸化とS315のリン酸化・脱リン酸化は独立に起こることができて、それぞれ相加的にCERT機能を制御しうることを明らかにしました[62]。CERT S315のリン酸化・脱リン酸化を司るキナーゼ・ホスファターゼはまだ同定されていないものの、SRMを含むこれら一連の研究の結果は、CERTが複数のキナーゼ・ホスファターゼ系で制御されていることを示しております[62]。
脂質を転移するタンパク質lipid transfer proteins (LTPs)には今や少なくとも7つのファミリーとそれらの多くのメンバーが見つかっておりますが、CERTは機能の点からだけでなく制御の点においてもその分子メカニズムの解析が(今のところ)他を先んじており、LTPs研究の重要なモデル系と目されていると思われます。
10.CERTがかかわるそのほかの最近の情報
抗癌剤への耐性はガン治療における大きな障害のひとつです。興味深いことに、CERT活性を阻害するといろいろな抗癌剤耐性が解除される(薬剤が効くようになる)ことが培養細胞レベルでしめされました[44, 45]。この現象には、小胞体で合成されたセラミドの代謝不全が細胞へあたえるストレスがかかわっていると推察されています[44, 45]。
モノクローナル抗体医薬などの生物医薬品は、 CHO細胞などの培養細胞で組換え体として生産させたものを原料としている例が多数あります。よって、目的の組換え体タンパク質を効率的に細胞培養液中に放出させることは、生物医薬品の生産性の向上につながるので、とくに製薬企業の生産現場では大切な課題となっています。上で紹介したCERT S132A活性化変異体をCHO細胞に発現させるなどしてCERT機能を高進させると、モノクローナル抗体の生産性が二倍以上になるそうです[46]。スフィンゴミエリンの合成はゴルジ体のタンパク質分泌能におそらく重要ですので[41, 47]、CERT機能の増強によりスフィンゴミエリンの合成が高まり、その結果、ゴルジ体の分泌機能が高まったのかもしれません。
膜接触部位における分子引き抜き転移は、真核細胞における脂質合成などの生理的反応だけでなく、宿主細胞に寄生したウイルスや細菌が宿主由来の栄養素などを奪う病理的反応にもかかわっているらしいことも、あきらかになりつつあります[48-50]。
病原体とCERTとのかかわりで、私たちがとくに注目しているのは、宿主細胞のなかでしか増えることができない偏性寄生細菌のクラミジア菌です。クラミジア菌の増殖には宿主細胞のスフィンゴ脂質が必要であると、10年以上も前に報告されていました[51]。そして、2011年に、クラミジア菌は宿主細胞の合成するセラミドを利用しており、そのさいにCERTをハイジャックしているらしいこと、それも菌の住む寄生胞と宿主細胞の小胞体との間の膜接触部位でセラミドが運ばれているらしいという報告が、二つの研究グループからおなじ雑誌のおなじ号に発表されました[48, 49]。(そのひとつに私は共同研究者として関わっています。簡単な紹介はこちら)
クラミジア・トラコマスChlamydia trachomatisは、日本など多くの先進国において性感染症(sexually transmitted diseases; STD)の最大起因病原体ですし、開発途上国ではこの菌が目に感染しておこる結膜炎を完治できずに繰り返す炎症による視力喪失がおおきな公衆衛生上の問題となっています。クラミジア菌の基礎研究は研究者人口もあまり多くないようですので、私たちが提供できる宿主細胞側の実験材料やアプローチ方法により微力ながらも貢献したいと考えております。
私たち以外の研究グループからもCERT/GPBPΔ26に関する論文は遺伝子破壊動物の解析結果なども含めてかなりの数が出てきており、CERTが細胞内セラミド輸送に関与することは広く認知されてきました。私たちがCERTを発見した2003年の原著論文を引用している論文数は、私たちが共著者である論文を除いても、たとえば下の引用文献リストの[52]-[57]など、400を越えています。
ただし、GPBP/CERTLは細胞外に分泌されていろいろな細胞外マトリックスと結合するという報告もありますので[58-60]、GPBP/CERTLには細胞外での役割もあるのかもしれません。また、Saus博士らの報告が主張するようにGPBPやGPBPΔ26(つまりCERT)にキナーゼ活性があるとしても、このタンパク質のどの部分にキナーゼ領域があるのかは未解決です。
TALEN法やCRISPR/Cas9法の開発により、哺乳類の培養細胞においても目的の遺伝子を簡単に欠失させることが可能な時代がついに到来しました。長らく哺乳動物培養細胞を実験材料に用いて研究を行っている私にとっても、このようなゲノム編集技術は「こんな方法があったらよいのに」と思い描いていた正に夢の技術です。2011年(平成23年)9月に開催された生化学会のランチョンセミナーでTALEN法の紹介があり、すぐさま飛びついてHeLa細胞への応用を試みました。いろいろな”初期不良“を克服することで、疑似3倍体のHeLa細胞でも三つのCERT対立遺伝子座全てをノックアウトすることに成功しました[63]。目的とするゲノム遺伝子の配列やexon構造で難易はあるものの、基本的に試みた全ての遺伝子でノックアウトは成功し、グルコシルセラミド合成酵素遺伝子とCERT遺伝子の両方を欠損させた二重変異HeLa細胞の作出もできています[63]。ここで構築した細胞パネルは今後のスフィンゴ脂質研究に大いに役立つでありましょう(簡単な説明はこちら)。
この節で紹介したように、私たち自身でさえ予想もできなかった方面にもCERTがインパクトをおよぼしつつあるようです。応用面も含めたいろいろなことにCERTの研究が役立つというのは、研究者冥利でもあり、ありがたく思います。
11.今後の研究の展望
生体膜は、タンパク質と脂質とをそのおもな成分としています。膜タンパク質の細胞内輸送に関わる分子群はすでに数多くみつかっており、粗面小胞体で合成された膜タンパク質がほかのオルガネラへと運ばれるのは輸送小胞を利用したメカニズムによることがあきらかになっています。一方、小胞体(おそらく滑面小胞体)で合成された膜脂質の選別輸送メカニズムは、CERTの発見やオルガネラ膜接触部位の存在の再認識をきっかけとして、「分子引き抜き転移」というまったく別のメカニズムで語られつつあります。
私(花田)にとって、CERTの研究は(たとえ細々とでも)かならず継続してゆきたいテーマです。今後は、CERT機能の制御のメカニズムをさらにあきらかにするだけでなく、CERTがかかわって膜接触部位がかたちづくられる可能性の検証もしてゆきたいと考えております。
余談1
いま思いかえすと、「ライセニン耐性変異株を分離してみよう」と思うにいたる一連の出来事は、自然科学の神がさりげなく落とした大きなチャンスであったことがよくわかります。このチャンスをちゃんと拾えたのは、ルイス・パスツール(Louis Pasteur, 1822-1895年)がのたもうた「観察(研究)の世界では、幸運の女神は準備している者にしか微笑まない。”In the fields of observation, chance favors the prepared mind.”」ということなのですと少しく自慢しておきたいと思います。
余談2
2001年の暮れもおしつまった12月晦日近くに、数年間を費やしてやっと手にしたcDNA配列をDNA配列データベースにたいしてホモロジー検索にかけ、「Type 4 collagen ---, 4型コラーゲン云々」との回答がモニターに表示されたときには、「よりによってコラーゲンとは!クローニングは完全に失敗だ。LY-A株がセラミド輸送欠損株と主張していたこと自体も間違いだったのか?」と愕然となりました。もう夜遅いのでその日は悶々と帰宅し、翌日に悄然としてその論文を読んでみると、コラーゲンそのものではなく、コラーゲンに結合するキナーゼという報告内容だったので少し息を吹き返しました。内容的に首をかしげるような情報がところどころにあったので思いなおして(本文参照)、タンパク質の機能ドメインの類似性検索をおこなってみると--- 脂質転移に関連しそうなSTARTドメインをGPBPやGPBPΔ26はもっているではありませんか!
「これはセラミド輸送タンパク質そのものであるかもしれない!」と、おおいに勇気づけられて、先に進めたわけです。私たちの手で、大腸菌で発現させて精製した組換え体CERT/GPBPΔ26やGPBP/CERTLをしらべたかぎりでは、セラミド転移活性は観察されても、キナーゼ活性を認めることはまだできていません(未発表結果)。このような未発表の観察結果も含めますと、このタンパク質の本来の役割は細胞内のセラミド輸送であると明確に主張するには、CERTという新しい名前を与えることがやはり妥当であると思われます。
余談3
CERTという名称は、生理機能にちなんでつけたわけですが、命名にあたり、英語として短い一言で発音できることも念頭に入れていました。CERTなら、「本命馬」の意味をもつ普通名詞certとおなじく”サート”と一音節で言えます。改名を提示できずにGPBPΔ26のままにしておけば、ceramide transportという役目を類推できない名前のまま、ジー・ピー・ビー・ピー・デルタ・ツウェンティー・シクスという長い音節の名称を使い続けることになったでしょう。既存の科学用語を、新しい知見などを織り込みつつ、多くのひとにとって使い勝手のよい合理的なものになるように適切に改訂することは必要です。
引用文献
[1] van Meer G, Voelker DR, Feigenson GW (2008) Membrane lipids: where they are and how they behave, Nat Rev Mol Cell Biol, 9, 112-124.
[2] Soccio RE, Breslow JL (2004) Intracellular cholesterol transport, Arterioscler Thromb Vasc Biol, 24, 1150-1160.
[3] Raetz CR, Whitfield C (2002) Lipopolysaccharide endotoxins, Annu Rev Biochem, 71, 635-700.
[4] Okuda S, Freinkman E, Kahne D (2012) Cytoplasmic ATP hydrolysis powers transport of lipopolysaccharide across the periplasm in E. coli, Science, 338, 1214-1217.
[5] Hanada K (2003) Serine palmitoyltransferase, a key enzyme of sphingolipid metabolism, Biochim Biophys Acta, 1632, 16-30.
[6] Merrill AH, Jr. (2012) Sphingolipid and glycosphingolipid metabolic pathways in the era of sphingolipidomics, Chem Rev, 111, 6387-6422.
[7] Ardail D, Popa I, Bodennec J, Louisot P, Schmitt D, Portoukalian J (2003) The mitochondria-associated endoplasmic-reticulum subcompartment (MAM fraction) of rat liver contains highly active sphingolipid-specific glycosyltransferases, Biochem J, 371, 1013-1019.
[8] Kohyama-Koganeya A, Sasamura T, Oshima E, Suzuki E, Nishihara S, Ueda R, Hirabayashi Y (2004) Drosophila glucosylceramide synthase: a negative regulator of cell death mediated by proapoptotic factors, J Biol Chem, 279, 35995-36002.
[9] Sekizawa Y, Kubo T, Kobayashi H, Nakajima T, Natori S (1997) Molecular cloning of cDNA for lysenin, a novel protein in the earthworm Eisenia foetida that causes contraction of rat vascular smooth muscle, Gene, 191, 97-102.
[10] Yamaji A, Sekizawa Y, Emoto K, Sakuraba H, Inoue K, Kobayashi H, Umeda M (1998) Lysenin, a novel sphingomyelin-specific binding protein, J Biol Chem, 273, 5300-5306.
[11] Kobayashi H, Ohta N, Umeda M (2004) Biology of lysenin, a protein in the coelomic fluid of the earthworm Eisenia foetida, Int Rev Cytol, 236, 45-99.
[12] Kiyokawa E, Baba T, Otsuka N, Makino A, Ohno S, Kobayashi T (2005) Spatial and functional heterogeneity of sphingolipid-rich membrane domains, J Biol Chem, 280, 24072-24084.
[13] Hanada K, Hara T, Fukasawa M, Yamaji A, Umeda M, Nishijima M (1998) Mammalian cell mutants resistant to a sphingomyelin-directed cytolysin. Genetic and biochemical evidence for complex formation of the LCB1 protein with the LCB2 protein for serine palmitoyltransferase, J Biol Chem, 273, 33787-33794.
[14] Fukasawa M, Nishijima M, Hanada K (1999) Genetic evidence for ATP-dependent endoplasmic reticulum-to-Golgi apparatus trafficking of ceramide for sphingomyelin synthesis in Chinese hamster ovary cells, J Cell Biol, 144, 673-685.
[15] Pagano RE, Martin OC, Kang HC, Haugland RP (1991) A novel fluorescent ceramide analogue for studying membrane traffic in animal cells: accumulation at the Golgi apparatus results in altered spectral properties of the sphingolipid precursor, J Cell Biol, 113, 1267-1279.
[16] Funakoshi T, Yasuda S, Fukasawa M, Nishijima M, Hanada K (2000) Reconstitution of ATP- and cytosol-dependent transport of de novo synthesized ceramide to the site of sphingomyelin synthesis in semi-intact cells, J Biol Chem, 275, 29938-29945.
[17] Fukasawa M, Nishijima M, Itabe H, Takano T, Hanada K (2000) Reduction of sphingomyelin level without accumulation of ceramide in Chinese hamster ovary cells affects detergent-resistant membrane domains and enhances cellular cholesterol efflux to methyl-beta -cyclodextrin, J Biol Chem, 275, 34028-34034.
[18] Hanada K, Kumagai K, Yasuda S, Miura Y, Kawano M, Fukasawa M, Nishijima M (2003) Molecular machinery for non-vesicular trafficking of ceramide, Nature, 426, 803-809.
[19] Raya A, Revert F, Navarro S, Saus J (1999) Characterization of a novel type of serine/threonine kinase that specifically phosphorylates the human goodpasture antigen, J Biol Chem, 274, 12642-12649.
[20] Raya A, Revert-Ros F, Martinez-Martinez P, Navarro S, Rosello E, Vieites B, Granero F, Forteza J, Saus J (2000) Goodpasture antigen-binding protein, the kinase that phosphorylates the goodpasture antigen, is an alternatively spliced variant implicated in autoimmune pathogenesis, J Biol Chem, 275, 40392-40399.
[21] Kumagai K, Yasuda S, Okemoto K, Nishijima M, Kobayashi S, Hanada K (2005) CERT mediates intermembrane transfer of various molecular species of ceramides, J Biol Chem, 280, 6488-6495.
[22] Kawano M, Kumagai K, Nishijima M, Hanada K (2006) Efficient trafficking of ceramide from the endoplasmic reticulum to the Golgi apparatus requires a VAMP-associated protein-interacting FFAT motif of CERT, J Biol Chem, 281, 30279-30288.
[23] Balla T, Szentpetery Z, Kim YJ (2009) Phosphoinositide signaling: new tools and insights, Physiology (Bethesda), 24, 231-244.
[24] Sugiki T, Takeuchi K, Yamaji T, Takano T, Tokunaga Y, Kumagai K, Hanada K, Takahashi H, Shimada I (2012) Structural basis for the Golgi association by the pleckstrin homology domain of the ceramide trafficking protein (CERT), J Biol Chem, 287, 33706-33718.
[25] Ponting CP, Aravind L (1999) START: a lipid-binding domain in StAR, HD-ZIP and signalling proteins, Trends Biochem Sci, 24, 130-132.
[26] Kudo N, Kumagai K, Tomishige N, Yamaji T, Wakatsuki S, Nishijima M, Hanada K, Kato R (2008) Structural basis for specific lipid recognition by CERT responsible for nonvesicular trafficking of ceramide, Proc Natl Acad Sci U S A, 105, 488-493.
[27] Kudo N, Kumagai K, Matsubara R, Kobayashi S, Hanada K, Wakatsuki S, Kato R (2010) Crystal structures of the CERT START domain with inhibitors provide insights into the mechanism of ceramide transfer, J Mol Biol, 396, 245-251.
[28] Sugiki T, Takahashi H, Nagasu M, Hanada K, Shimada I (2010) Real-time assay method of lipid extraction activity, Anal Biochem, 399, 162-167.
[29] Loewen CJ, Roy A, Levine TP (2003) A conserved ER targeting motif in three families of lipid binding proteins and in Opi1p binds VAP, Embo J, 22, 2025-2035.
[30] Hanada K (2006) Discovery of the molecular machinery CERT for endoplasmic reticulum-to-Golgi trafficking of ceramide, Mol Cell Biochem, 286, 23-31.
[31] Hanada K, Kumagai K, Tomishige N, Kawano M (2007) CERT and intracellular trafficking of ceramide, Biochim Biophys Acta, 1771, 644-653.
[32] Hanada K, Kumagai K, Tomishige N, Yamaji T (2009) CERT-mediated trafficking of ceramide, Biochim Biophys Acta, 1791, 684-691.
[33] Hanada K (2010) Intracellular trafficking of ceramide by ceramide transfer protein, Proc Jpn Acad Ser B Phys Biol Sci, 86, 426-437.
[34] Friedman JR, Voeltz GK (2011) The ER in 3D: a multifunctional dynamic membrane network, Trends Cell Biol, 21, 709-717.
[35] Staehelin LA (1997) The plant ER: a dynamic organelle composed of a large number of discrete functional domains, Plant J, 11, 1151-1165.
[36] Mogelsvang S, Marsh BJ, Ladinsky MS, Howell KE (2004) Predicting function from structure: 3D structure studies of the mammalian Golgi complex, Traffic, 5, 338-345.
[37] Holthuis JC, Levine TP (2005) Lipid traffic: floppy drives and a superhighway, Nat Rev Mol Cell Biol, 6, 209-220.
[38] Elbaz Y, Schuldiner M (2011) Staying in touch: the molecular era of organelle contact sites, Trends Biochem Sci, 36, 616-623.
[39] Helle SC, Kanfer G, Kolar K, Lang A, Michel AH, Kornmann B (2013) Organization and Function of Membrane Contact Sites, Biochim Biophys Acta,
[40] Kumagai K, Kawano M, Shinkai-Ouchi F, Nishijima M, Hanada K (2007) Interorganelle trafficking of ceramide is regulated by phosphorylation-dependent cooperativity between the PH and START domains of CERT, J Biol Chem, 282, 17758-17766.
[41] Fugmann T, Hausser A, Schoffler P, Schmid S, Pfizenmaier K, Olayioye MA (2007) Regulation of secretory transport by protein kinase D-mediated phosphorylation of the ceramide transfer protein, J Cell Biol, 178, 15-22.
[42] Tomishige N, Kumagai K, Kusuda J, Nishijima M, Hanada K (2009) Casein kinase I{gamma}2 down-regulates trafficking of ceramide in the synthesis of sphingomyelin, Mol Biol Cell, 20, 348-357.
[43] Saito S, Matsui H, Kawano M, Kumagai K, Tomishige N, Hanada K, Echigo S, Tamura S, Kobayashi T (2008) Protein phosphatase 2Cepsilon is an endoplasmic reticulum integral membrane protein that dephosphorylates the ceramide transport protein CERT to enhance its association with organelle membranes, J Biol Chem, 283, 6584-6593.
[44] Swanton C, Marani M, Pardo O, Warne PH, Kelly G, Sahai E, Elustondo F, Chang J, Temple J, Ahmed AA, Brenton JD, Downward J, Nicke B (2007) Regulators of mitotic arrest and ceramide metabolism are determinants of sensitivity to paclitaxel and other chemotherapeutic drugs, Cancer Cell, 11, 498-512.
[45] Lee AJ, Roylance R, Sander J, Gorman P, Endesfelder D, Kschischo M, Jones NP, East P, Nicke B, Spassieva S, Obeid LM, Birkbak NJ, Szallasi Z, McKnight NC, Rowan AJ, Speirs V, Hanby AM, Downward J, Tooze SA, Swanton C (2012) CERT depletion predicts chemotherapy benefit and mediates cytotoxic and polyploid-specific cancer cell death through autophagy induction, J Pathol, 226, 482-494.
[46] Florin L, Pegel A, Becker E, Hausser A, Olayioye MA, Kaufmann H (2009) Heterologous expression of the lipid transfer protein CERT increases therapeutic protein productivity of mammalian cells, J Biotechnol, 141, 84-90.
[47] Olayioye MA, Hausser A (2012) Integration of non-vesicular and vesicular transport processes at the Golgi complex by the PKD-CERT network, Biochim Biophys Acta, 1821, 1096-1103.
[48] Elwell CA, Jiang S, Kim JH, Lee A, Wittmann T, Hanada K, Melancon P, Engel JN (2011) Chlamydia trachomatis co-opts GBF1 and CERT to acquire host sphingomyelin for distinct roles during intracellular development, PLoS Pathog, 7, e1002198.
[49] Derre I, Swiss R, Agaisse H (2011) The lipid transfer protein CERT interacts with the Chlamydia inclusion protein IncD and participates to ER-Chlamydia inclusion membrane contact sites, PLoS Pathog, 7, e1002092.
[50] Amako Y, Syed GH, Siddiqui A (2011) Protein kinase D negatively regulates hepatitis C virus secretion through phosphorylation of oxysterol-binding protein and ceramide transfer protein, J Biol Chem, 286, 11265-11274.
[51] van Ooij C, Kalman L, van I, Nishijima M, Hanada K, Mostov K, Engel JN (2000) Host cell-derived sphingolipids are required for the intracellular growth of Chlamydia trachomatis, Cell Microbiol, 2, 627-637.
[52] Perry RJ, Ridgway ND (2006) Oxysterol-binding protein and vesicle-associated membrane protein-associated protein are required for sterol-dependent activation of the ceramide transport protein, Mol Biol Cell, 17, 2604-2616.
[53] Rao RP, Yuan C, Allegood JC, Rawat SS, Edwards MB, Wang X, Merrill AH, Jr., Acharya U, Acharya JK (2007) Ceramide transfer protein function is essential for normal oxidative stress response and lifespan, Proc Natl Acad Sci U S A, 104, 11364-11369.
[54] Wang X, Rao RP, Kosakowska-Cholody T, Masood MA, Southon E, Zhang H, Berthet C, Nagashim K, Veenstra TK, Tessarollo L, Acharya U, Acharya JK (2009) Mitochondrial degeneration and not apoptosis is the primary cause of embryonic lethality in ceramide transfer protein mutant mice, J Cell Biol, 184, 143-158.
[55] Halter D, Neumann S, van Dijk SM, Wolthoorn J, de Maziere AM, Vieira OV, Mattjus P, Klumperman J, van Meer G, Sprong H (2007) Pre- and post-Golgi translocation of glucosylceramide in glycosphingolipid synthesis, J Cell Biol, 179, 101-115.
[56] D'Angelo G, Polishchuk E, Di Tullio G, Santoro M, Di Campli A, Godi A, West G, Bielawski J, Chuang CC, van der Spoel AC, Platt FM, Hannun YA, Polishchuk R, Mattjus P, De Matteis MA (2007) Glycosphingolipid synthesis requires FAPP2 transfer of glucosylceramide, Nature, 449, 62-67.
[57] Mencarelli C, Losen M, Hammels C, De Vry J, Hesselink MK, Steinbusch HW, De Baets MH, Martinez-Martinez P (2010) The ceramide transporter and the Goodpasture antigen binding protein: one protein--one function?, J Neurochem, 113, 1369-1386.
[58] Revert F, Ventura I, Martinez-Martinez P, Granero-Molto F, Revert-Ros F, Macias J, Saus J (2008) Goodpasture antigen-binding protein is a soluble exportable protein that interacts with type IV collagen. Identification of novel membrane-bound isoforms, J Biol Chem, 283, 30246-30255.
[59] Granero-Molto F, Sarmah S, O'Rear L, Spagnoli A, Abrahamson D, Saus J, Hudson BG, Knapik EW (2008) Goodpasture antigen-binding protein and its spliced variant, ceramide transfer protein, have different functions in the modulation of apoptosis during zebrafish development, J Biol Chem, 283, 20495-20504.
[60] Mencarelli C, Bode GH, Losen M, Kulharia M, Molenaar PC, Veerhuis R, Steinbusch HW, De Baets MH, Nicolaes GA, Martinez-Martinez P (2012) Goodpasture antigen-binding protein/ceramide transporter binds to human serum amyloid P-component and is present in brain amyloid plaques, J Biol Chem, 287, 14897-14911.
[61] Olsen JV, Blagoev B, Gnad F, Macek B, Kumar C, Mortensen P, Mann M (2006). Global, in vivo, and site-specific phosphorylation dynamics in signaling networks. Cell 127, 635-648.
[62] Kumagai K, Kawano-Kawada M, Hanada K (2014) Phosphoregulation of CERT at serine 315 in the interaction with VAMP-associated protein (VAP) for inter-organelle trafficking of ceramide in mammalian cells, J Biol Chem, 289, 10748-10760.
[63] Yamaji T, Hanada K (2014) Establishment of HeLa cell mutants deficient in sphingolipid-related genes by using TALENs, PLoS ONE, 9, e88124.
花田賢太郎(感染研 品質保証・管理部、細胞化学部併任)
(2013年2月18日)(2014年7月22日 9-4節、10節一部の追加改訂2016年9月13日 一部修文、 2017年9月29日一部修文)
(2018年11月19日 図2:Dihydroceramide desaturase反応改訂)(2021年4月1日 所属更新)
関連する他のページ一覧
III. 哺乳動物細胞におけるセラミド輸送に関する研究(このページ)
V. Vero細胞の物語 ~その樹立からゲノム構造の決定、そして未来へ~
その他の記事
2. スフィンゴ脂質およびセラミドの命名事始め(外部サイトへリンク)
3. セラミド研究史概略(外部サイトへリンク)
1.スフィンゴ脂質の化学構造と生物界での分布
スフィンゴ脂質sphingolipidとは、スフィンゴイド塩基sphingoid baseとよばれる長鎖アミノアルコールlong-chain amino alcoholを骨格としてもつ一群の脂質です(図1)[1-4]。哺乳動物細胞におけるスフィンゴ脂質のスフィンゴイド塩基は、主にスフィンゴシンsphingosineであり、そのアミノ基にアシル基がアミド結合するとセラミドとなり、そして、セラミドにさまざまな親水性の頭部が結合して複合スフィンゴ脂質complex sphingolipids (分子中にリン、イオウ、アミノ酸、糖などを含むスフィンゴ脂質)となります(図1)。
図1
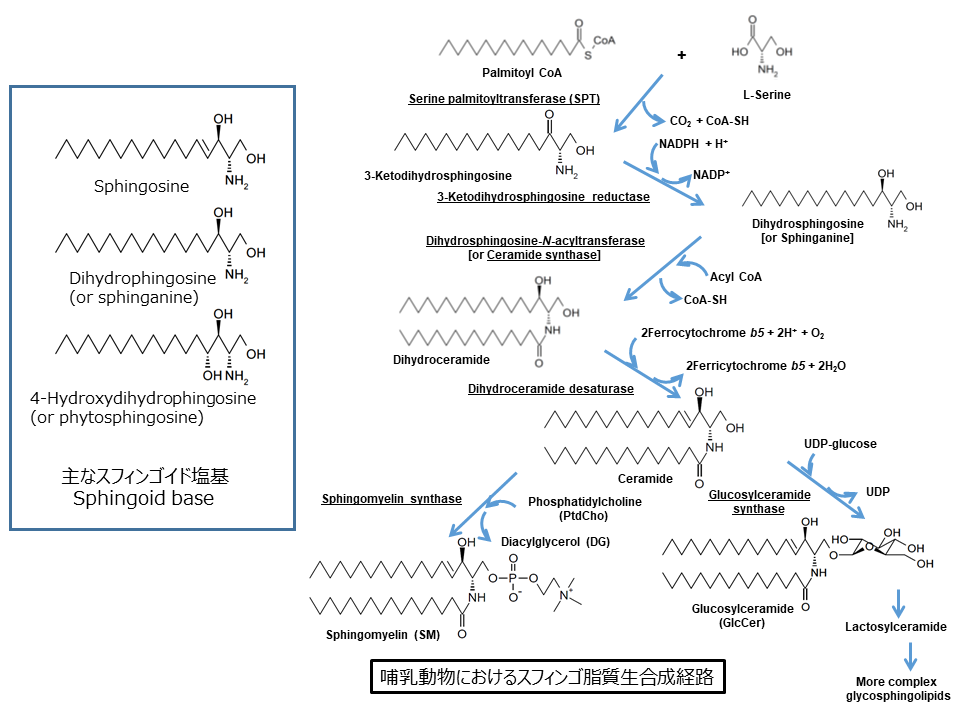
スフィンゴ脂質の基本骨格である長鎖アミノアルコール構造をスフィンゴシンと命名したのは、この脂質群を最初に発見したドイツの医生化学者Johann L. W. Thudichum (1829-1901)です。Thudichum(英語圏の人はスディヒャムもしくはツディヒャムと発音しているようです)は、臓器から溶媒抽出しにくい性質をもったこの不思議な脂質群を、「謎」を意味するSphinxもしくは「固く結合する」を意味するsphingeinにちなんで命名したといわれております(参考図書:山川民夫『糖脂質物語』、講談社学術文庫)。
スフィンゴ脂質の命名に関する追加情報とSphinxについては本章の末尾(次ページ)に余談をつけています。
セラミドにホスホコリンphoshocholineがエステル結合したリン脂質は、スフィンゴミエリンsphingomyelinとよばれ、哺乳動物細胞の総リン脂質の5-10%を占めています。下等動物では、ホスホコリンではなくホスホエタノールアミンphosphoethanolamineやホスホノエタノールアミンphosphonoethanolamine(生物界では珍しいC-P結合がある!)がセラミドにエステル結合したスフィンゴリン脂質がしばしばみられます(図2)[5, 6]。酵母やカビおよび植物は、スフィンゴミエリンをもちませんが、高等動物ではみられないホスホイノシトール含有スフィンゴ脂質phosphoinositol-containing sphingolipidsをもちます(図2)[7-10]。
図2
糖のついたスフィンゴ脂質(スフィンゴ糖脂質glycosphingolipids)もまた生物界に広く存在しています[5, 11]。糖鎖部分の構造はとても多様性に富んでおり、おなじ生物個体のなかでさえスフィンゴ糖脂質の発現パターンは、細胞の種類によってかなりちがいます[12-14]。
細菌には、例外的な細菌をのぞいてスフィンゴ脂質はありません。スフィンゴモナスSphingomonas属の細菌はグラム陰性細菌でありながらリポ多糖がなく、その代わりにスフィンゴ糖脂質を表面構成因子としてもっております[15]。スフィンゴバクテリウムSphingobacterium属からはホスホイノシトール含有スフィンゴ脂質がみつかっていますし[16]、歯周病原性細菌Porphyromonas gingivalisもスフィンゴ脂質を合成できる例外的な細菌です[17]。また、動物細胞内に寄生して増殖するクラミジアChlamydia菌は宿主細胞のつくるスフィンゴ脂質を菌の増殖に利用しています[18]。
グリセロールglycerolを骨格としてもつ脂質群は、グリセロ脂質glycerolipidsとよばれ、細菌からヒトまでほぼすべての生物に存在しています。ヒトとパン酵母のあいだで、グリセロ脂質の構造はほとんど差がありませんが、スフィンゴ脂質の構造は上で述べたようにおおきく異なります[4]。このスフィンゴ脂質の構造の多様性は、なにかしらの進化のうえでの意義とリンクしていると想像されますもののその意義の多くは謎のままです。
2.哺乳動物におけるスフィンゴ脂質の生合成経路
スフィンゴ脂質の生合成では、セリンパルミトイル転移酵素(serine palmitoyltransferase; SPT)が触媒するセリンとパルミトイル palmitoyl CoAとの縮合反応からはじまり、いくつかの反応を経てセラミドとなります(図1)[2, 4]。哺乳動物細胞においては、セラミドはさらにスフィンゴミエリンもしくはグルコシルセラミドglucosylceramideへと変換され、グルコシルセラミドはさらに複雑なスフィンゴ糖脂質へと変換されます(図1)。
3.スフィンゴ脂質の生理と病理
スフィンゴ脂質は、多くの生理機能に関与していることがわかってきています[12, 13, 19, 20]。そして、その代謝の異常は、いくつかの遺伝病の原因と知られるだけでなく[21-23]、成人病やガンそして認知症といった現代の主要疾病にも関わっています[24, 25]。最近では、スフィンゴ脂質代謝をターゲットとした病気の予防や治療さえも現実のものとなってきています[26-28]。また、スフィンゴ脂質は、当研究所のミッションである感染症研究にかかわりが深い脂質でもあります[29-31]。
本ホームページ内でスフィンゴ脂質の生理機能や病態との関わりの詳細を説明することは、当研究部の研究成果を紹介するというこのホームページの目的を超えますので控えますが、関連する総説を文中に引用しましたので、興味のある方はそれら総説をご覧ください。また、この課題に詳しい日本の研究グループのホームページもおおいに参考になると思います。
4.私たちがスフィンゴ脂質の研究に参画したきっかけなど
今でこそ注目もされるようになったスフィンゴ脂質ではありますが、現部長の花田が研究員として本研究所に職を得た1980年代の終わりころは、スフィンゴ脂質を取り扱う研究者の数も少なく、生合成経路や生理的意義といった基本的なことがらでさえも不明な点がいろいろと残されておりました。そこで、私たちは、スフィンゴ脂質の生合成の最初のステップを行うSPTの活性がほとんど失われるようになる動物細胞変異株を分離して、この変異株の解析から、スフィンゴ脂質が動物細胞の生育に必須であることなどをあきらかにしてきました[32-39]。このような地道な研究を進めているうちに、細胞内セラミド輸送が欠損している変異細胞にめぐり会うことになり、それはセラミド選別輸送を担う分子装置CERTの発見に結びついてゆきます。この経緯は本ホームページの他の項目、III.哺乳動物細胞におけるセラミド輸送に関する研究をご覧ください。
余談1 Thudichumの著書とスフィンゴミエリン、スフィンゴシンの登場
スフィンゴミエリンsphingomyelin、スフィンゴシンsphingosineという用語が初めて文献上で登場したのは、1884年に出版されたJohann Ludwig Wilhelm Thudichumの著書"A Treatise on the Chemical Constitution of the Brain"においてと思われます。この本の内容はwebで見ることも可能です(https://archive.org/stream/b23984570/b23984570_djvu.txt)。また、復刻版(by D.L. Drabkin, Archon Books, Hamden CT, 1962)も出ており、それを中古本として海外から購入することができましたので以下に写真付きで紹介します。

この本の本文中でSphingomyelinとsphingosine (この本ではsphingosinという表記)という用語が最初に出てくるのは第一章のイントロダクションです。そこでの記載によると、Thudichum自身が予備的な解析から1874年に報告していたapomyelinを本格的に解析し、この二窒素一リン酸含有脂質(dinitrogenized monophosphatidates)をsphinomyelinと名付け直したとのこと。ただし、ここでは何故sphingoという接頭辞のような言葉を思いついたのかには触れていません。その少し後にsphingomyelinの分解成分としてsphingosinという用語が登場しますがsphingoの意味はここでも記載されていません。そして、脳から抽出・分離した様々な脂質群の化学的性質を記載した「実験結果」に相当する章において、セレブロシドcerebroside(現在でいうところのガラクトシルセラミドgalactosylceramide) を化学分解した後に得られる冷エーテル難溶性物質を以下のように記載しています(上図の右下パネル参照)。
“to which, in commemoration of the many enigmas which it presented to the inquirer, I have given the name of Sphingosin,”
「(アルカロイドとしての特性をもつこの冷エーテル難溶性物質に対して)探究者たる私に多くの謎を呈してきた記念として、Sphingosinという名を与えることにした」
Sphinxという語句こそ出てきませんが、この記載からSphingosin はSphinxにつながるネーミングであると考えてよいでしょう。
先述した1874年に出版された予備報告の内容を知ることが今のところ私にはできません。よって、Sphingosinのネーミングとその説明の初登場はこの” Thudichum, J.L.W. (1874) Researches on the chemical constitution of the brain. Report of the Medical Officer of the Privy Council and Local Government Board, 3 :113 “のほうにあるのかもしれないことをお断りしておきます。 しかし、米国ジョージア工科大学のAlfred Merrill, Jr.博士(スフィンゴ脂質分野の著名な研究者の一人であり、その歴史に関しての造詣も深い)にメールで尋ねたことろ、同氏は1874年の報告の写しも持っており、その中ではまだsphingosinという文言は出てきていないと回答をくれました。
ところで、写真の復刻本の本を編んだDrabkinが復刻当時(1962年)の知識をもって作成した用語説明GlossaryのSphingosinの項に以下の記載があります。
”The name is derived from the Greek, sphingein, meaning: to bind tight.”
「この名称は、固く結ぶを意味するギリシャ語のsphingeinに由来している」
Drabkinのこの記載の由来がThudichumの書いた文章のどこにあるのか私にはまだ見つけられておりません。一方、Sphinxという名詞そのものがギリシャ語のsphingeinという動詞に由来するという説は別途存在していて、また、この説への反論もあるようです。言葉の成り立ちからして謎めいているわけですね。
余談2 スフィンクス
女人の顔と獣の胴体をもつスフィンクスSphinxは、古代エジプトの神聖獣であり、王家を守るためにいまもピラミッドの近くに座っております。
少し時代が下がったギリシア神話中の怪物スフィンクスは、テーベThebes(古代地名はテバイThebai)の近くの山に住み、通りかかる旅人に謎々を質問して、答えられぬと食べていました。誰も正解を答えられずに大変迷惑していたところ、旅人オイディプスOedipusが二つの謎にあっさりと正解し、スフィンクスは自らを恥じて崖から身を投げました。オイディプスは、つい先ごろ王を失ったテーベ市民に認められ新しい王となり、未亡人たる王妃と結婚します。しかしなんと、オイディプスは先の王とその妃との実子なのです。その昔、神託によって自分の子供に殺されるから子供をもうけるなとされていた王は、それでも酔った勢いで妻を妊娠させてしまいます。王は、生まれたばかりの男の子を殺せと命じましたが、不憫に思った部下によって密かに他人の手にわたされたその子は、オイディプスと名付けられ、親子お互いを知らぬままに育ちます。青年オイディプスは、両親を殺すことになるからテーベには行くなと神託されていたにもかかわらずテーベに向かい、旅をしていた先王をふとした喧嘩がもとで刺殺してしまいますが、彼が下手人とは誰も知らないままに、スフィンクスの謎に答えてテーベの王になってしまうのです。つまるところ、オイディプスは実父を殺して王となり、実母と結婚したことになります。そのことをあとで知り、王妃は縊死し、オイディプスは気が狂って自分の両眼をつぶし街からも追い出されてしまうというのがこの物語の結末です。参考図書:串田孫一『ギリシア神話』(旺文社文庫など)
幾分なりともハッピーな結末が用意されている今どきの物語に比べると、オイディプスの物語はなんとも不条理に満ちたものですが、神の定めた運命には逆らえないと信じるならば、これはこれで条理なのかもしれません。
精神分析学者ジークムント・フロイト(Sigmund Freud, 1856-1939)は、幼い男子が母親を独り占めしたくて父親を憎みがちであることを指摘し、この状態をオイディプスの父親殺し・母親姦の物語にちなんで「オイディプス・コンプレックス(日本ではエディプス・コンプレックスとよくよばれる)」と名付けました。
なお、スフィンクスがオイディプスに問うた二つの謎とは以下のようなものです。
「朝は四本足、昼は二本足、夕方は三本足。これは何か?」
「二人の姉妹で、一方が他を生み、また反対の一方も他方を生むものは何か?」
答えの気になる方はギリシア神話をひもといてみてください。
引用文献
(digital object identifier, doi: わかる論文のみ記載)
[1] Karlsson KA (1970) On the chemistry and occurrence of sphingolipid long-chain bases, Chem Phys Lipids, 5, 6-43. doi:
[2] Hanada K (2003) Serine palmitoyltransferase, a key enzyme of sphingolipid metabolism, Biochim Biophys Acta, 1632, 16-30. doi:10.1016/S1388-1981(03)00059-3.
[3] Merrill AH, Jr. (2011) Sphingolipid and glycosphingolipid metabolic pathways in the era of sphingolipidomics, Chem Rev, 111, 6387-6422. doi: 10.1021/cr2002917.
[4] Hanada K (2014) Co-evolution of sphingomyelin and the ceramide transport protein CERT, Biochim Biophys Acta, 1841, 704-719. [Corrigendum (2014) 1841, 1561-1562; doi: 10.1016/j.bbalip.2014.08.002].
[5] Hori T, Sugita M (1993) Sphingolipids in lower animals, Prog Lipid Res, 32, 25-45. doi:
[6] Garrett TA, Schmeitzel JL, Klein JA, Hwang JJ, Schwarz JA (2013) Comparative lipid profiling of the cnidarian Aiptasia pallida and its dinoflagellate symbiont, PLoS One, 8, e57975. doi: 10.1371/journal.pone.0057975.
[7] Dickson RC (2008) Thematic review series: sphingolipids. New insights into sphingolipid metabolism and function in budding yeast, J Lipid Res, 49, 909-921. doi: 10.1194/jlr.R800003-JLR200.
[8] Sperling P, Heinz E (2003) Plant sphingolipids: structural diversity, biosynthesis, first genes and functions, Biochim Biophys Acta, 1632, 1-15. doi:
[9] Berkey R, Bendigeri D, Xiao S (2012) Sphingolipids and plant defense/disease: the "death" connection and beyond, Front Plant Sci, 3, 68. doi: 10.3389/fpls.2012.00068.
[10] Ternes P, Wobbe T, Schwarz M, Albrecht S, Feussner K, Riezman I, Cregg JM, Heinz E, Riezman H, Feussner I, Warnecke D (2011) Two pathways of sphingolipid biosynthesis are separated in the yeast Pichia pastoris, J Biol Chem, 286, 11401-11414. doi: 10.1074/jbc.M110.193094.
[11] Wiegandt H (1992) Insect glycolipids, Biochim Biophys Acta, 1123, 117-126. doi:
[12] Hakomori SI (2008) Structure and function of glycosphingolipids and sphingolipids: recollections and future trends, Biochim Biophys Acta, 1780, 325-346. doi: 10.1016/j.bbagen.2007.08.015.
[13] Furukawa K, Ohkawa Y, Yamauchi Y, Hamamura K, Ohmi Y, Furukawa K (2012) Fine tuning of cell signals by glycosylation, J Biochem, 151, 573-578. doi: 10.1093/jb/mvs043.
[14] Inokuchi J (2011) Physiopathological function of hematoside (GM3 ganglioside), Proc Jpn Acad Ser B Phys Biol Sci, 87, 179-198. doi:
[15] Kawasaki S, Moriguchi R, Sekiya K, Nakai T, Ono E, Kume K, Kawahara K (1994) The cell envelope structure of the lipopolysaccharide-lacking gram-negative bacterium Sphingomonas paucimobilis, J Bacteriol, 176, 284-290. doi:
[16] Naka T, Fujiwara N, Yano I, Maeda S, Doe M, Minamino M, Ikeda N, Kato Y, Watabe K, Kumazawa Y, Tomiyasu I, Kobayashi K (2003) Structural analysis of sphingophospholipids derived from Sphingobacterium spiritivorum, the type species of genus Sphingobacterium, Biochim Biophys Acta, 1635, 83-92. doi:
[17] Nichols FC, Riep B, Mun J, Morton MD, Bojarski MT, Dewhirst FE, Smith MB (2004) Structures and biological activity of phosphorylated dihydroceramides of Porphyromonas gingivalis, J Lipid Res, 45, 2317-2330. doi: 10.1194/jlr.M400278-JLR200.
[18] van Ooij C, Kalman L, van I, Nishijima M, Hanada K, Mostov K, Engel JN (2000) Host cell-derived sphingolipids are required for the intracellular growth of Chlamydia trachomatis, Cell Microbiol, 2, 627-637. doi:
[19] Hannun YA, Obeid LM (2008) Principles of bioactive lipid signalling: lessons from sphingolipids, Nat Rev Mol Cell Biol, 9, 139-150. doi: 10.1038/nrm2329.
[20] Zheng W, Kollmeyer J, Symolon H, Momin A, Munter E, Wang E, Kelly S, Allegood JC, Liu Y, Peng Q, Ramaraju H, Sullards MC, Cabot M, Merrill AH, Jr. (2006) Ceramides and other bioactive sphingolipid backbones in health and disease: lipidomic analysis, metabolism and roles in membrane structure, dynamics, signaling and autophagy, Biochim Biophys Acta, 1758, 1864-1884. doi: 10.1016/j.bbamem.2006.08.009.
[21] Kolter T, Sandhoff K (2006) Sphingolipid metabolism diseases, Biochim Biophys Acta, 1758, 2057-2079. doi: 10.1016/j.bbamem.2006.05.027.
[22] Auer-Grumbach M (2008) Hereditary sensory neuropathy type I, Orphanet J Rare Dis, 3, 7. doi: 10.1186/1750-1172-3-7.
[23] Vitner EB, Platt FM, Futerman AH (2010) Common and uncommon pathogenic cascades in lysosomal storage diseases, J Biol Chem, 285, 20423-20427. doi: 10.1074/jbc.R110.134452.
[24] Holland WL, Summers SA (2008) Sphingolipids, insulin resistance, and metabolic disease: new insights from in vivo manipulation of sphingolipid metabolism, Endocr Rev, 29, 381-402. doi: 10.1210/er.2007-0025.
[25] Hla T, Dannenberg AJ (2012) Sphingolipid signaling in metabolic disorders, Cell Metab, 16, 420-434. doi: 10.1016/j.cmet.2012.06.017.
[26] Zeidan YH, Hannun YA (2007) Translational aspects of sphingolipid metabolism, Trends Mol Med, 13, 327-336. doi: 10.1016/j.molmed.2007.06.002.
[27] Chiba K, Kataoka H, Seki N, Shimano K, Koyama M, Fukunari A, Sugahara K, Sugita T (2011) Fingolimod (FTY720), sphingosine 1-phosphate receptor modulator, shows superior efficacy as compared with interferon-beta in mouse experimental autoimmune encephalomyelitis, Int Immunopharmacol, 11, 366-372. doi: 10.1016/j.intimp.2010.10.005.
[28] Garofalo K, Penno A, Schmidt BP, Lee HJ, Frosch MP, von Eckardstein A, Brown RH, Hornemann T, Eichler FS (2011) Oral L-serine supplementation reduces production of neurotoxic deoxysphingolipids in mice and humans with hereditary sensory autonomic neuropathy type 1, J Clin Invest, 121, 4735-4745. doi: 10.1172/JCI57549.
[29] Hanada K (2005) Sphingolipids in infectious diseases, Jpn J Infect Dis, 58, 131-148. (Open access: https://www0.niid.go.jp/JJID/58/131.pdf)
[30] Heung LJ, Luberto C, Del Poeta M (2006) Role of sphingolipids in microbial pathogenesis, Infect Immun, 74, 28-39. doi: 10.1128/IAI.74.1.28-39.2006.
[31] Zhang K, Bangs JD, Beverley SM (2010) Sphingolipids in parasitic protozoa, Adv Exp Med Biol, 688, 238-248. doi:
[32] Hanada K, Nishijima M, Akamatsu Y (1990) A temperature-sensitive mammalian cell mutant with thermolabile serine palmitoyltransferase for the sphingolipid biosynthesis, J Biol Chem, 265, 22137-22142. (Open access: http://www.jbc.org/content/265/36/22137.long)
[33] Hanada K, Nishijima M, Kiso M, Hasegawa A, Fujita S, Ogawa T, Akamatsu Y (1992) Sphingolipids are essential for the growth of Chinese hamster ovary cells. Restoration of the growth of a mutant defective in sphingoid base biosynthesis by exogenous sphingolipids, J Biol Chem, 267, 23527-23533. (Open access: http://www.jbc.org/content/267/33/23527.long)
[34] Hanada K, Nishijima M, Akamatsu Y, Pagano RE (1995) Both sphingolipids and cholesterol participate in the detergent insolubility of alkaline phosphatase, a glycosylphosphatidylinositol-anchored protein, in mammalian membranes, J Biol Chem, 270, 6254-6260. (Open access: http://www.jbc.org/content/270/11/6254.long)
[35] Hanada K, Hara T, Fukasawa M, Yamaji A, Umeda M, Nishijima M (1998) Mammalian cell mutants resistant to a sphingomyelin-directed cytolysin. Genetic and biochemical evidence for complex formation of the LCB1 protein with the LCB2 protein for serine palmitoyltransferase, J Biol Chem, 273, 33787-33794. (Open access: http://www.jbc.org/content/273/50/33787.long)
[36] Hanada K, Hara T, Nishijima M (2000) Purification of the serine palmitoyltransferase complex responsible for sphingoid base synthesis by using affinity peptide chromatography techniques, J Biol Chem, 275, 8409-8415. (Open access: http://www.jbc.org/content/275/12/8409.long)
[37] Hanada K, Mitamura T, Fukasawa M, Magistrado PA, Horii T, Nishijima M (2000) Neutral sphingomyelinase activity dependent on Mg2+ and anionic phospholipids in the intraerythrocytic malaria parasite Plasmodium falciparum, Biochem J, 346 Pt 3, 671-677. (Open access: http://www.biochemj.org/bj/346/0671/bj3460671.htm)
[38] Bejaoui K, Uchida Y, Yasuda S, Ho M, Nishijima M, Brown RH, Jr., Holleran WM, Hanada K (2002) Hereditary sensory neuropathy type 1 mutations confer dominant negative effects on serine palmitoyltransferase, critical for sphingolipid synthesis, J Clin Invest, 110, 1301-1308. doi: 10.1172/JCI16450.
[39] Yasuda S, Nishijima M, Hanada K (2003) Localization, topology, and function of the LCB1 subunit of serine palmitoyltransferase in mammalian cells, J Biol Chem, 278, 4176-4183. doi: 10.1074/jbc.M209602200. (Open access: http://www.jbc.org/content/278/6/4176.long).
花田賢太郎(感染研 品質保証・管理部、細胞化学部併任)
(2013年2月10日)(2014年3月31日 改訂)(2016年10月18日 図1::GlcCer構造図改訂)(2017年1 月13 日 余談1追加)
(2018年11月19日 図1:Dihydroceramide desaturase反応改訂)(2021年4月1日 所属更新)
関連する他のページ一覧
II. スフィンゴ脂質について(このページ)
IV. 病原体による宿主脂質ハイジャック機序の解明と創薬への応用
VI. Vero細胞の物語 ~その樹立からゲノム構造の決定、そして未来へ~
その他の記事
2. スフィンゴ脂質およびセラミドの命名事始め(外部サイトへリンク)
3. セラミド研究史概略(外部サイトへリンク)
*Hanada K (2014) Co-evolution of sphingomyelin and the ceramide transport protein CERT,
Biochim Biophys Acta, 1841, 704-719. doi: 10.1016/j.bbalip.2013.06.006 [Corrigendum (2014) 1841, 1561-1562; doi: 10.1016/j.bbalip.2014.08.002].
平成29年4月21日更新
細胞化学部 第1室
Home 研究・業務 メンバー 論文 リンク
第一室は、プリオン病(クロイツフェルト・ヤコブ病、ウシ海綿状脳症など)に関する研究を行っています。
プリオン病は「伝達性海綿状脳症(transmissible spongiform encephalopathy; TSE)」という神経変性疾患の別名です。この病気では、脳などの中枢神経組織の神経細胞が脱落して、特徴的な空胞変性(いわゆるスポンジ状の変性;右図→)を生じます。TSEの原因は長らく不明でしたが、1980年代に米国のS.B.Prusiner教授がTSE病原体は蛋白質の凝集体から成ることを見出し、病原体を「プリオン」と名付けました(1997年のノーベル生理学・医学賞受賞)。これ以来、TSEはしばしばプリオン病と呼ばれるようになっています。プリオンの本体は、本来は健常な神経組織などに存在している「正常型プリオン蛋白質」の構造が変化した「異常型プリオン蛋白質」であると考えられています (この構造変化では、プリオン蛋白質のαへリックス構造が減少してβシート構造が増加します。βシート構造に富む 異常型プリオン蛋白質の 詳しい構造はまだ完全には 解明されていません)。神経組織の 病変部位には、異常型プリオン蛋白質が蓄積・凝集します。病原体がDNAやRNAなどの遺伝物質を持たずに蛋白質の凝集体であるという点において、プリオンはウイルスや細菌とは大きく異なっています。
ヒトのプリオン病の発症背景はやや複雑です。最も多いのは、発症の原因が不明であり、世界のどの国でもおよそ100万人に1人の割合で発症患者さんが現れる孤発性クロイツフェルト・ヤコブ病(CJD)です。この他に、遺伝性のものと感染性のものが知られています。孤発性の場合でも、蓄積した異常型プリオン蛋白質には感染性があるために、クロイツフェルト・ヤコブ病は 感染症法の対象疾患に指定されています(5類感染症)。また、1990年代に新興感染症として英国において 発生したヒト・変異型CJDは、1980年代後半に同国で蔓延したウシのプリオン病(BSE、ウシ海綿状脳症)が畜産物を介してヒトへ感染したものであり、大きな社会問題となりました。この社会問題に対処すべく、BSEや変異型CJDについての対策と研究が現在に至るまで全世界的に進められてきました。
「スクレーピー」と呼ばれるヒツジのプリオン病が世の中に存在することを、人類はおよそ200年前から気づいていました(*)。しかし、プリオン病の科学的な理解が深まったのは、20世紀後半を過ぎてからです。 プリオン病は、古くて新しい病気です。第1室では、プリオン病の理解を一層深めるための研究を進めています。また、行政と連携して、 食肉衛生検査所のBSE検査において陽性や擬陽性となったウシのBSE確認検査を他の機関と協力して行い、食肉の安全確保に努めています(**)。
花田の研究テーマなど
生物がつくる水に溶けない低分子が脂質です。脂質は、生物の基本ユニットである細胞において内外を隔てる膜のおもな成分であり、水から自動的に分離するという特性を膜の形成に発揮しています。さらに、脂質は、重さ当たりの酸化的エネルギー備蓄が大きいので栄養としても重要であり、環境からの情報を細胞内へ伝達する際の制御因子としても働くなど、多彩な生物学的役割をもっています。
水に溶けない脂質を生体内のような親水的な環境においてうまく利用するには、そのための特別な仕組みがあるはずです。しかし、その仕組みを解き明かすことは、水と油を同時に扱わねばならぬ技術的むずかしさもあり、意外なほどに遅れています。
スフィンゴ脂質は、スフィンゴシンとよばれる構造をもった脂質の一群であり、真核生物には普遍的に存在しています。スフィンゴ脂質は、ヒト自身がもつさまざまな脂質群のなかで病原体との相互作用に一番関わっている脂質群でもあります。私たちは、哺乳動物細胞におけるスフィンゴ脂質の生合成とその制御機構を生化学的手法と遺伝学的手法とを駆使しながら研究しています。その主な内容は、病原体そのもののではなく、宿主細胞側の研究ですが、哺乳動物細胞におけるスフィンゴ脂質の代謝や役割に関する研究の成果が、感染病原体と宿主細胞との相互作用を解明することや遺伝病の原因を解明することなどに貢献し、疾病の予防・治療といった応用面への波及効果をしめすようになってきています。
病原体を増殖させうる培養細胞は、未知の病原体の同定から新規ワクチンの開発に至るまで、感染症対策になくてはならない重要な研究資源です。適切な培養細胞の創出は感染症対策に限らず生物医薬全般への波及効果があり、必要な培養細胞を創出する戦略を生み出すことは世界的な医療イノベーション競争においてその資源基盤を押さえるという国益上の見逃せない側面もあると考えられます。しかし、培養細胞の開発・改良には長い時間と多くの試行錯誤を要するという問題が常につきまとっています。
私たちは、哺乳動物培養細胞におけるゲノムワイドな解析手法(レンチウイルスベクター上に構築したshRNAライブラリやCRISPR/CAS9ゲノム編集ライブラリを用いた細胞遺伝学的手法など)を取り入れて、最新の手法を駆使しながら、感染症に関する宿主細胞側からの重要な情報や細胞材料を提供する研究にも取り組んでいます。そのような方向性の研究を展開する準備の一つとして、微生物学研究だけでなくワクチン生産においても広く使われているアフリカミドリザル腎臓由来Vero細胞の全ゲノム配列を他機関との共同研究により、世界に先駆けて決定しました。
Vero細胞の研究に関しては別ページに詳細に解説し、培養細胞に関する主な専門用語も別途説明しました。
以下のホームページでは、花田が関わってきた研究の主なものを、いくつかの項目に分けて、詳しくご紹介してゆきます。記事は、随時ふやしてゆきたいと思います。
それぞれの項目はお互いに関係していますが、項目ごとに読んでもその内容がなるべくわかるように配慮したつもりです。そのため、それぞれの記事の間に図表を含めて重複部分があります。
一緒に研究してみたいと思う方は、私に連絡をください(hanak[at]nih.go.jp; [at]を@に変換するとメールアドレスになります)。
私のプロフィールなどはResearchmapに記載しています。
花田賢太郎(感染研 品質保証・管理部、細胞化学部併任)
(2013年2月20日)(2015年6月23日一部改訂、2016年9月13日 一部修文)(2021年3月29日 一部修文)(2021年4月1日 所属更新)
V. Vero細胞の物語 ~その樹立からゲノム構造の決定、そして未来へ~
VI.病原体による宿主脂質ハイジャック機序の解明と創薬への応用
その他の記事
2. スフィンゴ脂質およびセラミドの命名事始め(外部サイトへリンク)
3. セラミド研究史概略(外部サイトへリンク)
外部リンク
細胞化学部 第1室
Home 研究・業務 メンバー 論文 リンク
室長
深澤 征義 <Masayoshi Fukasawa> (事務取扱)
主任研究官
桶本(中村) 優子 <Yuko Okemoto-Nakamura>
萩原 健一 <Ken'ichi Hagiwara>
染谷 友美 <Tomomi Someya>
実習生
小澤 彩香 <Ayaka Ozawa>
獲得外部資金-前濱朝彦
平成23年6月1日
細胞化学部
前濱朝彦
| 文部科学省 科学研究費補助金 |
挑戦的萌芽研究 | 平成23年~ 平成24年 |
| 三菱財団 | (分担)自然科学研究助成 | 平成23年 |
| 文部科学省 科学研究費補助金 |
挑戦的萌芽研究 | 平成21年~ 平成22年 |
| 文部科学省 科学研究費補助金 |
特定領域研究「G蛋白質シグナル」 | 平成20年~ 平成21年 |
| 文部科学省 科学研究費補助金 |
基盤研究B | 平成19年~ 平成21年 |
| 文部科学省 科学研究費補助金 |
萌芽研究 | 平成19年~ 平成20年 |
| 文部科学省 科学研究費補助金 |
特定領域研究「G蛋白質シグナル」 | 平成18年~ 平成19年 |
| 文部科学省 科学研究費補助金 |
(分担)萌芽研究 | 平成17年 |
| 文部科学省 科学研究費補助金 |
(分担)基盤研究B | 平成16年~ 平成17年 |
| 文部科学省 科学研究費補助金 |
若手研究B | 平成16年~ 平成17年 |
| 文部科学省 科学研究費補助金 |
(分担)基盤研究B | 平成14年~ 平成15年 |
| 病態代謝研究会 | 研究助成金 | 平成14年 |
| 厚生労働省 がん研究助成金 |
(分担)脂質によるがん制御に関する研究 | 平成13年~ 平成16年 |
| 文部科学省 科学研究費補助金 |
特定領域研究「がん生物」 | 平成13年 |
| 小野医学研究財団 | 研究奨励助成金 | 平成12年 |
| 上原記念生命財団 | 研究奨励金 | 平成12年 |